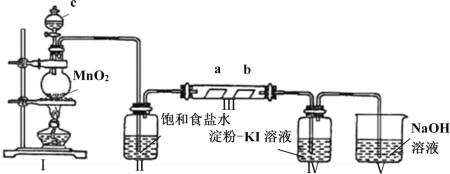
题目内容
【题目】用0.1000mol·L-1NaOH溶液分别滴定20.00ml0.1000mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COOH)>c(CH3COO-)
C.pH=7时,滴定盐酸消耗V(NaOH)大于醋酸消耗V(NaOH)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)═c(Cl-)
【答案】C
【解析】
A.滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误;
B. 加入10mL氢氧化钠时,醋酸与氢氧化钠溶液反应得到同浓度的醋酸和醋酸钠混合液,由图可知,溶液呈酸性,说明醋酸电离程度大于醋酸根离子的水解程度,则溶液中c(CH3COO-)>c(CH3COOH),故B错误;
C. 醋酸钠水解呈碱性,氯化钠不水解,pH=7时,盐酸完全反应,醋酸与氢氧化钠溶液反应得到醋酸和醋酸钠的混合液,则醋酸所用NaOH溶液的体积小,故C正确;
D. V(NaOH)=20.00mL时,盐酸和醋酸与氢氧化钠溶液反应生成氯化钠和醋酸钠,由于醋酸根离子发生水解,则c(CH3COO-)<c(Cl-),故D错误;
故选C。

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目