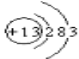题目内容
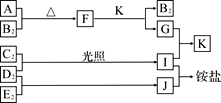
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
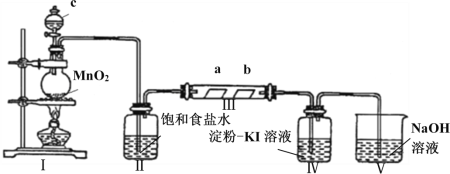
(1)装置Ⅰ中仪器c的名称是_______________,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为_______________________________________________________。
(2)装置Ⅱ的作用是________________________。
(3)实验过程中装置Ⅳ中的实验现象为______________________________。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与III之间添加下图中的_______装置(填序号)。

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式___________________。
【答案】分液漏斗 MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O 除去氯气中的氯化氢气体 无色溶液变为蓝色 ④ Cl2+2OH–=Cl–+ClO–+H2O
Mn2++Cl2↑+2H2O 除去氯气中的氯化氢气体 无色溶液变为蓝色 ④ Cl2+2OH–=Cl–+ClO–+H2O
【解析】
(1)装置Ⅰ中仪器c的名称是分液漏斗,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O;答案:分液漏斗;MnO2+4H++2Cl–
Mn2++Cl2↑+2H2O;答案:分液漏斗;MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)装置Ⅱ中盛有饱和食盐水,因为浓盐酸具有挥发性,则制取的氯气中混有氯化氢,用饱和食盐水可以除去杂质氯化氢,因此,答案是:除去氯气中的氯化氢气体。
(3)氯气具有氧化性,能够与碘化钾溶液反应生成碘单质,所以装置Ⅳ中通入氯气后,无色溶液变蓝色,因此,答案是:无色溶液变蓝色。
(4)干燥的氯气不具有漂白性,Ⅱ和Ⅲ之间可加干燥装置,除去氯气中的水蒸气,根据氯气的化学性质可知,应选浓硫酸作干燥剂,本题正确答案是:④ 。
(5)装置Ⅴ盛放的是氢氧化钠溶液,目的是防止尾气污染空气,反应的化学方程式为: Cl2+2OH–=Cl–+ClO–+H2O ,因此,答案是: Cl2+2OH–=Cl–+ClO–+H2O 。

【题目】Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因 _________________(用化学方程式表示,该反应为为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因 _____________________________。
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为______________________________________ ;
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+![]() O2 (g)== CO2 (g) △H1=-282.0 KJ/mol
O2 (g)== CO2 (g) △H1=-282.0 KJ/mol
H2(g)+![]() O2 (g)=== H2O (g) △H2=-241.8 KJ/mol
O2 (g)=== H2O (g) △H2=-241.8 KJ/mol
CH4(g)+ 2O2 (g)== CO2 (g)+ 2H2O (g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为___________。
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:
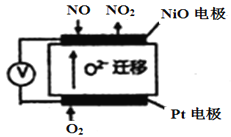
①Pt电极上发生的是 ______________反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为______________________________________;
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
比值(p/p0) | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
0~5min内,该反应的平均反应速率V(NO)=___________________;
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4span>(s);②NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是__________________ (用含a的式子表示)。
【题目】Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=_______________。
②3min时改变的反应条件是__________________(只填一种条件的改变即可)。
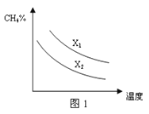
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1 ______X2(填“=”、“>”或“<”)。
Ⅱ.(4)已知常温下HCOOH的电离常数为![]() ,则HCOO—的水解反应HCOO- + H2O
,则HCOO—的水解反应HCOO- + H2O ![]() HCOOH + OH-的平衡常数K h =__________________。
HCOOH + OH-的平衡常数K h =__________________。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________。