题目内容
10.通常情况下,CO与O2的混合气体m L,用电火花引燃后体积变为n L(在相同条件下测定).(1)试确定原混合气体中CO与O2的体积.
(2)若反应后的气体密度在相同条件下为氢气的15倍时,试确定反应气体的组成及体积之比.
分析 (1)燃烧发生反应:2CO+O2═2CO2 ,利用差量法计算出反应消耗的CO和O2的体积,存在以下三种情况:①两者恰好完全,②CO过量时,③O2过量,据此讨论计算;
(2)根据反应后气体与氢气的相对密度计算出平均分子量,然后根据一氧化碳、氧气、二氧化碳的相对分子量确定反应后气体组成,再利用十字相乘法计算体积之比.
解答 解:由反应:2CO+O2═2 CO2 △V
2 1 2 1
2(m-n)L (m-n)L (m-n)L
①当两者恰好完全作用时,V(CO)=2(m-n) L,V(O2)=(m-n) L;
②当CO过量时,过量的CO的体积=m-[2(m-n)+(m-n)]=(3n-2m) L,原混合物中V(O2)=(m-n)L,V(CO)=(3n-2m) L+2(m-n) L=n L;
③当O2过量时,过量的O2的体积=m L-[2(m-n) L+(m-n) L]=(3n-2m) L,原混合物中V(CO)=2(m-n) L,V(O2)=(3n-2m) L+(m-n) L=(2n-m) L,
故答案为:①当两者恰好完全作用时,V(CO)=2(m-n) L,V(O2)=(m-n) L;
②当CO过量时,原混合物中V(O2)=(m-n)L,V(CO)=n L;
③当O2过量时,原混合物中V(CO)=2(m-n) L,V(O2)=(2n-m) L;
(2)若反应后的气体密度在相同条件下为氢气的15倍时,混合气体的平均相对分子质量是30,由于产物中肯定有CO2,它的相对分子质量大于30,所以另一种气体的相对分子质量必小于30,另一种气体只能是CO(也就是说O2不可能有余),该混合气体的组成可用下法求得: ,可得V(CO2):V(CO)=(28-2):(44-30)=1:7,
,可得V(CO2):V(CO)=(28-2):(44-30)=1:7,
故答案为:反应后气体为CO2、CO的混合气体,二者体积之比为1:7.
点评 本题考查混合物的有关计算,涉及讨论型过量计算,存在考查学生的分析计算能力,难度中等.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | SO2溶解于水 | B. | NO2溶解于水 | C. | CO2溶解于水 | D. | Cl2溶解于水 |
| A. | O2 | B. | Cl2 | C. | N2 | D. | CO2 |
| A. | A>B | B. | A=10-10 B | C. | B=10-4 A | D. | A=B |
| A. | mol/L | B. | mol/S | C. | mol/L•S | D. | mol/(L•min) |
| A. | 加入适量NaOH溶液 | B. | 加入适量盐酸 | ||
| C. | 加热 | D. | 通入CO2气体 |
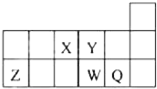
| A. | 元素Y与元素Z的最高正化合价之和的数值等于9 | |
| B. | 原子半径的大小顺序为:W>Z>Y | |
| C. | 离子半径的大小顺序为:W2->Y2->Z3+ | |
| D. | W的气态氢化物的热稳定性和还原性均比Q的氢化物的强 |
| A. | 30g二氧化硅晶体中含有Si-O键数目为2NA | |
| B. | 标准状况下,2.24L CHCl3的原子总数为0.1NA | |
| C. | 一定条件下,将1molN2与3molH2混合反应后,生成NH3分子的数目为2NA | |
| D. | 常温下,0.1mol/LNH4NO3溶液NO${\;}_{3}^{-}$的数目为0.1NA |
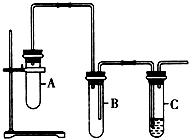 已知1,2-二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图实验装置.请回答下列问题.
已知1,2-二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图实验装置.请回答下列问题.