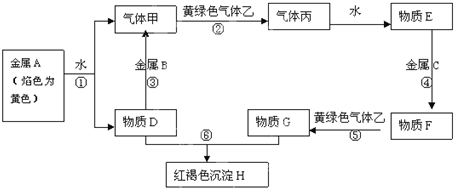
题目内容
5.在pH值都等于12的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol/L与Bmol/L,则A和B关系为( )| A. | A>B | B. | A=10-10 B | C. | B=10-4 A | D. | A=B |
分析 酸或碱抑制水电离,含有弱根离子的盐促进水电离,pH=12的氢氧化钠和醋酸钠,醋酸钠促进水电离,氢氧化钠抑制水电离,NaOH溶液中水电离出的c(OH-)=c(H+),醋酸钠溶液中水电离出的c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$.
解答 解:酸或碱抑制水电离,含有弱根离子的盐促进水电离,pH=12的氢氧化钠和醋酸钠,醋酸钠促进水电离,氢氧化钠抑制水电离,NaOH溶液中水电离出的c(OH-)=c(H+)=10-12mol/L,醋酸钠溶液中水电离出的c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=10-2 mol/L,
所以A:B=$\frac{1{0}^{-12}}{1{0}^{-2}}$=10-10,即:A=10-10B,
故选B.
点评 本题考查了水的电离及其影响,题目难度中等,明确酸溶液中的氢氧根离子、碱溶液中的氢离子是水电离的、能够水解的盐促进了水的电离为解答关键,注意掌握弱电解质的电离平衡及其影响因素.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
15.一定量的Na2O2与CO2反应后的固体物质41.8g,恰好与1L 1mol•L-1的稀盐酸完全反应,下列说法正确的是( )
| A. | 41.8g固体物质为Na2CO3 | |
| B. | 41.8g固体物质为0.1mol Na2CO3和0.4mol Na2O2的混合物 | |
| C. | 41.8g固体物质为31.2g NaHCO3和10.6g Na2CO3的混合物 | |
| D. | 一定量的Na2O2为78g |
19.双酚A也称BPA(结构如图所示),严重威胁着胎儿和儿童的健康,甚至癌症和新陈代谢紊乱导致的肥胖也被认为与此有关.下列关于双酚A的说法正确的是( )
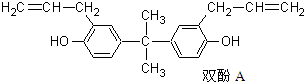

| A. | 该化合物的化学式为C20H24O2 | |
| B. | 该化合物与三氯化铁溶液反应显紫色 | |
| C. | 该化合物的所有碳原子处于同一平面 | |
| D. | 1mol双酚A最多可与4mol Br2发生取代反应 |
15.不粘锅是在普通锅的内侧涂覆上一层树脂而成,这层树脂的主要成分是聚四氟乙烯.洗衣店干洗西装是用有机溶剂来洗衣服的,目前使用的标准干洗剂的主要成分是四氯乙烯.关于聚四氟乙烯和四氯乙烯,下面的说法正确的是( )
| A. | 它们都是乙烯的同系物 | B. | 它们都属于混合物 | ||
| C. | 它们的分子中都含有C=C双键 | D. | 它们分子中都不含氢原子 |
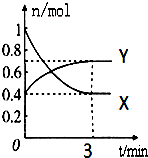 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)?N2O4g)(无色),如图所示. ;
;