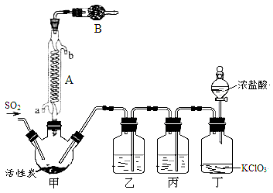
题目内容
【题目】请回答下列问题:
(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为:____________;与M同一周期的主族元素中原子半径最小的是(填元素符号)________。
(2)含有元素M的化合物Q是淡黄色固体,写出Q的电子式:______________。
(3)氧化铝溶液与过量氨水反应的离子方程式为____________________________________________;
生成物NH4Cl中存在的化学键类型为_____________________________。
(4)元素X、Y在周期表中位于同一主族,化合物Cu2X和Cu2Y可发生如下转化(其中D是纤维素水解的最终产物):
Cu2X![]() 澄清溶液
澄清溶液![]() 悬浊液
悬浊液![]() Cu2Y(砖红色沉淀)
Cu2Y(砖红色沉淀)
①D的分子式是_____________。
②Cu2Y与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:_______________________。
③硒(Se)是人体必需的微量元素,与元素Y同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为_________,其最高价氧化物对应的水化物化学式为_____________________。
该族25周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+99.7 kJ mol-1 b.+29.7 J mol-1 c.-20.6 J mol-1 d.-241.8 J mol-1
表示生成1 mol硒化氢反应热的是___________(填字母代号)。
【答案】  Cl
Cl 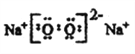 3NH3·H2O + Al3+=Al(OH)3↓+3NH4+ 离子键 共价键 C6H12O6 Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O 34 H2SeO4 b
3NH3·H2O + Al3+=Al(OH)3↓+3NH4+ 离子键 共价键 C6H12O6 Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O 34 H2SeO4 b
【解析】(1)NH4+所含电子数和质子数分别为10和11,说明元素M是钠离子,其原子结构示意图为: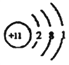 ;同周期主族元素从左到右原子半径依次减小,故与M同一周期的主族元素中原子半径最小的是Cl;(2)钠的化合物为淡黄色固体的是过氧化钠,其电子式为:
;同周期主族元素从左到右原子半径依次减小,故与M同一周期的主族元素中原子半径最小的是Cl;(2)钠的化合物为淡黄色固体的是过氧化钠,其电子式为: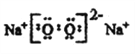 ;(3)氢氧化铝不溶于氨水,故氧化铝溶液与过量氨水反应的离子方程式为:3NH3·H2O + Al3+=Al(OH)3↓+3NH4+;NH4Cl中铵根离子和氯离子形成离子键,铵根离子中的氮原子和氢原子形成共价键;(4)①D是纤维素水解的最终产物,则D是葡萄糖,分子式为:C6H12O6;砖红色沉淀Cu2Y是氧化亚铜,悬浊液是新制氢氧化铜悬浊液,则澄清溶液是硝酸铜溶液,与过量浓硝酸反应的Cu2X是Cu2S;②Cu2O与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;③硒(Se)是人体必需的微量元素,与元素O同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为8+18+18=34,其最高价氧化物对应的水化物化学式为H2SeO4;同主族元素从上而下非金属性逐渐减弱,形成氢化物的稳定性逐渐减弱,则形成过程热效应增大(放热到吸热),Se是第四周期元素,则热效应应排第三,答案选b。
;(3)氢氧化铝不溶于氨水,故氧化铝溶液与过量氨水反应的离子方程式为:3NH3·H2O + Al3+=Al(OH)3↓+3NH4+;NH4Cl中铵根离子和氯离子形成离子键,铵根离子中的氮原子和氢原子形成共价键;(4)①D是纤维素水解的最终产物,则D是葡萄糖,分子式为:C6H12O6;砖红色沉淀Cu2Y是氧化亚铜,悬浊液是新制氢氧化铜悬浊液,则澄清溶液是硝酸铜溶液,与过量浓硝酸反应的Cu2X是Cu2S;②Cu2O与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;③硒(Se)是人体必需的微量元素,与元素O同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为8+18+18=34,其最高价氧化物对应的水化物化学式为H2SeO4;同主族元素从上而下非金属性逐渐减弱,形成氢化物的稳定性逐渐减弱,则形成过程热效应增大(放热到吸热),Se是第四周期元素,则热效应应排第三,答案选b。
。