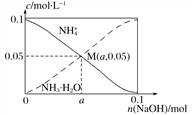
题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑦种元素,根据题意回答以下问题:

(1)在③~⑦五种元素中,原子半径最大的是____________(填元素符号);
(2)②的原子结构示意图为__________;
(3)①~⑦对应元素中最高价氧化物对应的水化物酸性最强的是________(填化学式,下同),呈两性的是________。
【答案】 Na ![]() HClO4 Al(OH)3
HClO4 Al(OH)3
【解析】考查元素周期表和元素周期表的应用,(1)电子层数越多,半径越大,同周期从左向右原子半径减小,原子半径最大的是③,即是Na;(2)②是F,其原子结构示意图是![]() ;(3)非金属性越强,其最高价氧化物的水化物酸性越强,因为F没有正价,因此酸性最强的是HClO4;氢氧化物呈现两性的是Al(OH)3。
;(3)非金属性越强,其最高价氧化物的水化物酸性越强,因为F没有正价,因此酸性最强的是HClO4;氢氧化物呈现两性的是Al(OH)3。

【题目】r—Fe2O3是一种具有磁性、催化、气敏的纳米材料。一种以硫铁矿烧渣等为原料制备r—Fe2O3的流程如下:

(1)下列有关“还原焙烧”工序的说法正确的是_____(填字母)。
a.焦炭应少量,空气应过量
b. 焙烧过程均为吸热反应,需用电炉持续加热反应器
c.“还原焙烧”的主要反应为 3C+2O2![]() 2CO+CO2、Fe2O3+CO
2CO+CO2、Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
(2)“浸取”前需将焙烧生成的熔体粉碎,其目的是_____________________。
(3)已知三种金属离子开始沉淀和完全沉淀的pH如下表:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀的pH | 2.2 | 7.5 | 4.1 |
完全沉淀的pH | 3.5 | 9.5 | 5.4 |
则“调pH”时,溶液的pH范围为_______________。
(4)滤渣1的主要成分为_________(填化学式);“沉铁”时发生反应的离子方程式为___________。
(5)“过滤2”时需用蒸馏水洗涤,能证明沉淀已洗涤干净的方法是_________;沉淀缓慢氧化为铁黄的化学方程式为________________。