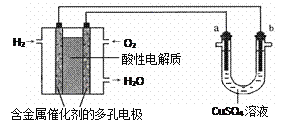
��Ŀ����
����Ŀ����ҵ����CO��H2�ϳ�CH3OH��CO��g��+2H2��g��![]() CH3OH��g������Ӧ��ƽ�ⳣ�����±���
CH3OH��g������Ӧ��ƽ�ⳣ�����±���
�¶�/�� | 0 | 100 | 200 | 300 | 400 |
ƽ�ⳣ�� | 667 | 13 | 1.9��10-2 | 2.4��10-4 | 1��10-5 |
����˵����ȷ����
A. �÷�Ӧ�ġ�H>0
B. ��ѹ������H2Ũ�Ⱥͼ�������������CO��ת����
C. ��ҵ�ϲ��ø��¸�ѹ��������Ŀ�Ķ������ԭ������ת����
D. t��ʱ����1 L�ܱ�������Ͷ��0.1 mol CO��0.2 mol H2��ƽ��ʱCOת����Ϊ50��������¶�ʱ��Ӧ��ƽ�ⳣ������ֵΪ100
���𰸡�D
��������A�����ݱ������ݿ�֪�����¶ȵ����ߣ�ƽ�ⳣ����С����˵�������¶�ƽ�����淴Ӧ�����ƶ����������Ӧ�Ƿ��ȷ�Ӧ�����HС��0��ѡ��A����B���������ܸı�ƽ��״̬�����ʹ�ô������ܸı�CO��ת���ʣ�ѡ��B����C����ҵ�ϲ���5 ��103 kPa��250�����������ԭ���Ǵ����Ļ����ڴ���������ǿ��ѡ��C����D�����ݷ���ʽ��֪
CO(g)��2H2(g) ![]() CH3OH(g)
CH3OH(g)
��ʼŨ�ȣ�mol/L�� 0.1 0.2 0
ת��Ũ�ȣ�mol/L�� 0.05 0.1 0.05
ƽ��Ũ�ȣ�mol/L�� 0.05 0.1 0.05
���Ը��¶���ƽ�ⳣ��K��![]() ��ѡ��D��ȷ����ѡD��
��ѡ��D��ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ