题目内容
【题目】下列金属中,人类最早较广泛使用的是
A.铁B.铝C.铜D.钛
【答案】C
【解析】
由于铜的活动性比较弱,以单质形式存在的比较多,在我国,距今4000年前的夏朝已经开始使用红铜,即天然铜.铁比铜活泼,到春秋时期才发现使用,铝的活动性比铁还强,难以炼制铝的单质,所以到近代才被大量应用,钛是21世纪的金属,人们利用它最晚,答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
A. 该反应的△H>0
B. 加压、增大H2浓度和加入催化剂都能提高CO的转化率
C. 工业上采用高温高压的条件,目的都是提高原料气的转化率
D. t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,下图所示是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程。
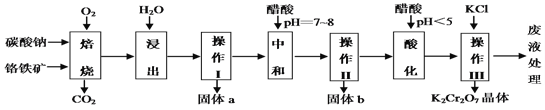
已知1:物质的溶解度(g/100g水)
物质 | 0℃ | 40℃ | 80℃ |
KCl | 28.0 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38.0 |
K2Cr2O7 | 4.7 | 26.3 | 73.0 |
Na2Cr2O7 | 163.0 | 215.0 | 376.0 |
已知2:①焙烧时有Na2CrO4、 Fe2O3 、NaAlO2 等生成。
②Cr2O72- + H2O ![]() 2CrO42- + 2H+ ;
2CrO42- + 2H+ ;
③Cr2O72-具有很强的氧化性
回答问题:
(1)“浸出”步骤中,为了提高浸出率,可采取的措施有加热、研磨或_______________等(要求写一条)。
(2)固体b中主要含有______________________(填写化学式)。
(3)要检测酸化操作中溶液的pH是否等于4.5,应该使用_______(填写仪器或用品名称)。
(4)酸化步骤用醋酸调节溶液的pH﹤5,其目的是____________________;不用盐酸调节溶液pH的原因是______________________________________。
(5)操作III发生反应的化学方程式是____________________________ ;
(6)写出焙烧时生成NaAlO2的化学方程式____________________。
【题目】KCl与KNO3在不同温度的溶解度数据如下表.则下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 |
KCl | 30g | 33g | 35g | 38g | 41g |
KNO3 | 21g | 31g | 45g | 65g | 88g |
A.KNO3比KCl的溶解度大
B.两种物质的溶解度相等的温度在20~30℃间
C.在20℃时,10g水中加入5gKCl可得到33.3% 的KCl溶液
D.在50℃时,两物质各5g分别加入l0g水中,充分溶解,均有固体剩余