题目内容
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
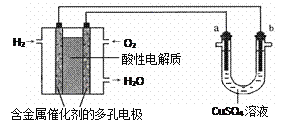
A. 燃料电池工作时,通入氢气的是正极
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
【答案】C
【解析】原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应,因此在该燃料电池中氢气在负极通入,氧气在正极通入,A错误;B、a极与燃料电池的正极相连,因此若a极是铁,b极是铜时,铁是阳极,铜是阴极,a极逐渐溶解,B不正确; C、若a极是粗铜,b极是纯铜时,则相当于粗铜的精炼,所以a极逐渐溶解,b极上有铜析出,C正确;D、若a、b极都是石墨,a电极是阳极,溶液中的氢氧根放电产生氧气,在相同条件下a极产生的气体与电池中消耗的H2体积不相等,后者是前者的2倍,D不正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
A. 该反应的△H>0
B. 加压、增大H2浓度和加入催化剂都能提高CO的转化率
C. 工业上采用高温高压的条件,目的都是提高原料气的转化率
D. t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100