��Ŀ����
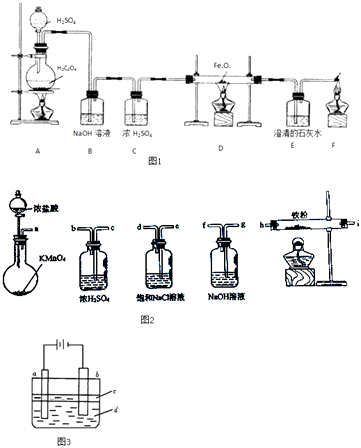
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3+��SO2 �� ijС����ͼ��ʾװ�ý���ʵ�飨�г�������A�еļ���װ�����ԣ��������Ѿ�������ϣ�ʵ�������ͼ�� 
���ɼ�K1��K4 �� ͨ��һ��ʱ��N2 �� �ٽ�T�͵��ܲ���B�У�����ͨ��N2 �� Ȼ��ر�K1��K3��K4 ��
����a���μ�һ������Ũ���ᣬ��A���ȣ�
��B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2 ��
��������b��ʹԼ2mL����Һ����D�Թ��У��������е������ӣ�
�������ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3 ��
���������Թ�D���ظ����̢�������B��Һ�е����ӣ�
��1�����̢��Ŀ���� ��
��2�����н������ҺΪ �� ������
��3��A�з�����Ӧ�Ļ�ѧ����ʽ ��
��4�����²��������Һ��Ƶ����ӷ�Ӧ�� �� ����д�Լ���ѧʽ������������������� ��
��5����˵��������Fe3+��SO2�����ӷ���ʽ�� ��
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������Cl2��Fe3+��SO2��������ס����ҡ�����������
���̢�B��Һ�к��е����� | ���̢�B��Һ�к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
���𰸡�
��1���ų�װ���е�����
��2������������Һ������Cl2��SO2,��ֹ��Ⱦ����
��3��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��4��2Fe2+Cl2�T2Fe3++2Cl���� KSCN����Һ���
��5��2Fe3++SO2+2H2O=2Fe2++SO42��+4H+
��6���ұ�
���������⣺��1��װ���д������������ʵ��������Ӱ�죬�����ž�װ���еĿ�����
���Դ��ǣ��ų�װ���е���������2��Cl2��SO2�ж���Ⱦ������Ӧ��β��������װ���е�����Ҫ����ǿ����Һ����Cl2��SO2����ֹ��Ⱦ������
���Դ��ǣ�����������Һ������Cl2��SO2����ֹ��Ⱦ��������3��A�з�����ӦΪ�Ʊ���������Ӧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����4����B����Һ���ʱ�����������������������������ӣ����ӷ���ʽΪ��2Fe2+Cl2�T2Fe3++2Cl������KSCN��Һ�������������ӣ���������Һ��죻
MnCl2+Cl2��+2H2O����4����B����Һ���ʱ�����������������������������ӣ����ӷ���ʽΪ��2Fe2+Cl2�T2Fe3++2Cl������KSCN��Һ�������������ӣ���������Һ��죻
���Դ��ǣ�2Fe2+Cl2�T2Fe3++2Cl����KSCN����Һ��죻��5������������ԭ��Ӧ����������������ǿ�ڻ�ԭ���������ԣ�����˵��������Fe3+��SO2�����ӷ���ʽ���������������������������ɶ�������������������ӷ���ʽΪ��2Fe3++SO2+2H2O=2Fe2++SO42��+4H+�����Դ��ǣ�2Fe3++SO2+2H2O=2Fe2++SO42��+4H+����6������������������ԭ��Ӧ����������������ǿ���������Ҳǿ�ڻ�ԭ���������ԣ�
�ף�B�����д����ܽ����������SO2���ʴ���
�ң�B�д���Fe3+��Fe2+��˵��Cl2������ǿ��Fe3+����û��Cl2ʣ�࣬�ʺ���SO42����˵��Fe3+������ǿ��SO2������ȷ��
����B�д���Fe3+��˵��Cl2������ǿ��Fe3+����������Fe2+��ֻ����Fe3+��SO2��ԭ������ȷ��
��ѡ���ұ���

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��ij��ѧС��ͨ���������ϣ��������ͼ��ʾ�ķ����Ժ����ϴ���Ϊԭ�����Ʊ�NiSO47H2O����֪ij�������ĺ����ϴ�����Ҫ����Ni��������Al��31%����Fe��1.3%���ĵ��ʼ�����������������ʣ�3.3%���� 
����������������������ʽ����ʱ��pH�����
������ | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Al��OH��3 | 3.8 | 5.2 |
Fe��OH��3 | 2.7 | 3.2 |
Fe��OH��2 | 7.6 | 9.7 |
Ai��OH��2 | 7.1 | 9.2 |
��1��������������з�����Ӧ�����ӷ���ʽ��
��2���������ʱ��������������ѧʽ����
��3������H2O2ʱ������Ӧ�����ӷ���ʽΪ
��4������bΪ������Һ��pH������ΪpH�ĵ��ط�Χ�� ��