题目内容
【题目】碳、氮、氧是同周期相邻的三种元素,碳、氮、氧及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
(1)碳、氮、氧的第一电离能由大到小顺序为
(2)H2O的中心原子杂化轨道空间构型为 , 固态H2O的晶体类型为 ,
(3)比较键角的大小:H2OCH4(填“>”“<”或“=”),原因为
(4)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为 .
【答案】
(1)N>O>C
(2)V形;分子晶体
(3)<;两种分子均采取sp3杂化,甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小
(4)
【解析】解:(1)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C, 所以答案是:N>O>C;(2)H2O分子中O原子价层电子对个数=2+ ![]() =4,所以O原子采用sp3杂化,分子空间构型是正四面体形,但含有两个孤电子对,所以分子构型为V形,H2O为共价化合物,形成分子晶体,
=4,所以O原子采用sp3杂化,分子空间构型是正四面体形,但含有两个孤电子对,所以分子构型为V形,H2O为共价化合物,形成分子晶体,
所以答案是:V形;分子晶体;(3)CH4中碳原子价层电子对个数=4+ ![]() =4,为sp3杂化,不含孤电子对,所以空间构型是正四面体形,其键角为109°28′,H2O中心原子O原子成2个σ键、含有
=4,为sp3杂化,不含孤电子对,所以空间构型是正四面体形,其键角为109°28′,H2O中心原子O原子成2个σ键、含有 ![]() =2对孤对电子,价层电子对个数=σ键个数+孤电子对个数=2+2=4,杂化轨道数为4,采取sp3杂化,H2O分子的立体构型是V形,其键角为104.5°,甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小,所以H2O的键角小于CH4 , 所以答案是:<;两种分子均采取sp3杂化,甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小;(4)N的质子数为7,H的质子数为1,NH4+中含有10个电子,11个质子,元素M的离子与NH4+所含电子数和质子数均相同,M的离子质子数为11,电子数为10,M为钠元素,则M的原子结构示意图为
=2对孤对电子,价层电子对个数=σ键个数+孤电子对个数=2+2=4,杂化轨道数为4,采取sp3杂化,H2O分子的立体构型是V形,其键角为104.5°,甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小,所以H2O的键角小于CH4 , 所以答案是:<;两种分子均采取sp3杂化,甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小;(4)N的质子数为7,H的质子数为1,NH4+中含有10个电子,11个质子,元素M的离子与NH4+所含电子数和质子数均相同,M的离子质子数为11,电子数为10,M为钠元素,则M的原子结构示意图为  ,
,
所以答案是:  .
.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图1和图2所示,请将数据填入表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= . 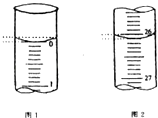
【题目】为验证氧化性:Cl2>Fe3+>SO2 , 某小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图: 
Ⅰ.打开弹簧夹K1~K4 , 通入一段时间N2 , 再将T型导管插入B中,继续通入N2 , 然后关闭K1、K3、K4 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2 .
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3 .
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是 .
(2)棉花中浸润的溶液为 . 作用是
(3)A中发生反应的化学方程式 .
(4)导致步骤Ⅲ中溶液变黄的离子反应是 . 用(写试剂化学式)检验氧化产物,现象是 .
(5)能说明氧化性Fe3+>SO2的离子方程式是 .
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是(填“甲”“乙”“丙”).
过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
