题目内容
【题目】甲、乙、丙三位同学分别做了以下三个实验.
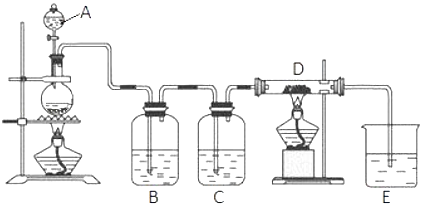
实验一:草酸晶体(H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4=CO2↑+CO↑+H2O.甲同学设计了如图1实验装置,用来制取干燥纯净的CO气体,并用生成的CO气体还原FexOy , 制取铁粉.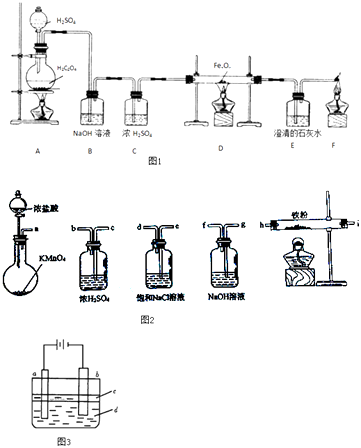
(1)装置B的作用是 . 装置E中的现象是 . 装置F的作用是 .
(2)若FexOy为0.4g,生成的气体与过量澄清石灰水反应生成0.75g白色沉淀,则FexOy的化学式为 .
实验二:乙同学用如图2所示仪器在实验室制备少量无水FeCl3 , 按气流由左到右顺序,仪器连接顺序的是 .
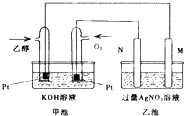
实验三:丙同学用如图3实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
①a电极材料为 , 其电极反应式为 .
②液体c为苯,其作用是 .
【答案】
(1)吸收制备CO时产生的CO2;澄清石灰水变浑浊;除CO防止污染空气
(2)Fe2O3;a﹣e﹣d﹣c﹣b﹣h﹣i﹣g;Fe;Fe﹣2e﹣=Fe2+;隔绝空气防止氢氧化亚铁被氧化
【解析】解:实验一:(1)草酸晶体(H2C2O4)在浓硫酸条件下加热分解:H2C2O4 ![]() CO2↑+CO↑+H2O,为了制取干燥纯净的CO气体,并用生成的CO气体还原FexOy , 制取铁粉,所以装置B氢氧化钠为吸收生成的二氧化碳气体,装置C浓硫酸为干燥CO,E澄清石灰水为检验CO还原FexOy生成的产物二氧化碳气体,则看到的现象为澄清石灰水变浑浊,最后F处点燃除去多余的CO,防止污染空气,所以答案是:吸收制备CO时产生的CO2;澄清石灰水变浑浊;除CO防止污染空气;(2)依据C守恒关系可得:CO~CO2~CaCO3 , 0.75g白色沉淀为碳酸钙,则:n(CaCO3)=n(CO)=
CO2↑+CO↑+H2O,为了制取干燥纯净的CO气体,并用生成的CO气体还原FexOy , 制取铁粉,所以装置B氢氧化钠为吸收生成的二氧化碳气体,装置C浓硫酸为干燥CO,E澄清石灰水为检验CO还原FexOy生成的产物二氧化碳气体,则看到的现象为澄清石灰水变浑浊,最后F处点燃除去多余的CO,防止污染空气,所以答案是:吸收制备CO时产生的CO2;澄清石灰水变浑浊;除CO防止污染空气;(2)依据C守恒关系可得:CO~CO2~CaCO3 , 0.75g白色沉淀为碳酸钙,则:n(CaCO3)=n(CO)= ![]() =7.5×10﹣3mol,则FexOy中氧元素的质量为:m(CO2)﹣m(CO)=44 gmol﹣1×7.5×10﹣3mol﹣28 gmol﹣1×7.5×10﹣3mol=0.12g,
=7.5×10﹣3mol,则FexOy中氧元素的质量为:m(CO2)﹣m(CO)=44 gmol﹣1×7.5×10﹣3mol﹣28 gmol﹣1×7.5×10﹣3mol=0.12g,
0.4g FexOy中铁元素的物质的量为:n(Fe)= ![]() =0.005mol,
=0.005mol,
0.4g FexOy中氧元素的物质的量为:n(O)= ![]() =0.0075 mol,
=0.0075 mol,
则: ![]() =
= ![]() =
= ![]() ,所以FexOy的化学式为Fe2O3 ,
,所以FexOy的化学式为Fe2O3 ,
所以答案是:Fe2O3;
实验二:实验室制备无水氯化铁,需要先制取纯净、干燥的氯气,用a装置制备氯气,故最先使用的仪器是a;
浓盐酸有挥发性,所以氯气中含有氯化氢气体,制取出的氯气中有HCl和水蒸气,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl﹣+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体,而洗气时,气体要长进短出,故接下来的气流的方向是e→d;
然后用浓硫酸干燥氯气,故接下来的气流的方向是c→b;
制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,故接下来连h;
氯气是污染性气体,对空气有污染,故应连接尾气处理装置,考虑到氯气是酸性气体,故要用碱液来吸收,故接下来通入NaOH 溶液,气流的方向是i→g;故仪器连接顺序正确的是a﹣e﹣d﹣c﹣b﹣h﹣i﹣g,所以答案是:a﹣e﹣d﹣c﹣b﹣h﹣i﹣g;
实验三:①制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,a电极反应式为Fe﹣2e﹣=Fe2+ , 所以答案是:Fe;Fe﹣2e﹣=Fe2+;
②苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对c溶液进行加热煮沸的目的是排出溶液中的氧气,所以答案是:隔绝空气防止氢氧化亚铁被氧化.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图1和图2所示,请将数据填入表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= . 
【题目】为验证氧化性:Cl2>Fe3+>SO2 , 某小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图: 
Ⅰ.打开弹簧夹K1~K4 , 通入一段时间N2 , 再将T型导管插入B中,继续通入N2 , 然后关闭K1、K3、K4 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2 .
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3 .
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是 .
(2)棉花中浸润的溶液为 . 作用是
(3)A中发生反应的化学方程式 .
(4)导致步骤Ⅲ中溶液变黄的离子反应是 . 用(写试剂化学式)检验氧化产物,现象是 .
(5)能说明氧化性Fe3+>SO2的离子方程式是 .
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是(填“甲”“乙”“丙”).
过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |