题目内容
17.用NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 1molC10H22分子中共价键总数为31NA | |
| C. | 7.1g氯气与足量的NaOH溶液反应,转移电子数为0.2NA | |
| D. | 9g重水中所含有的电子总数为5NA |
分析 A.依据n=CV计算;
B.依据烷烃分子结构计算化学键;
C.氯气与氢氧化钠发生歧化反应,氯从0价的单质氯变成-1价的NaCl中的氯,氯从0价的单质氯变成+1价的NaClO中的氯;
D.重水中的氢,1个重氢原子含1个质子,1个中子,1个重水分子含有10个电子;
解答 解:A.0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1mol•L-1×0.1L×NA=0.01NA,故A错误;
B.依据结构分析计算1mol C10H22分子中共价键总数=1mol(10-1+22)×NA=31NA,故B正确;
C.氯气与氢氧化钠反应:Cl2+2NaOH=NaCl+NaClO+H2O,1mol氯气完全反应,氯从0价的单质氯变成+1价的NaClO中的氯,失去1mol电子,氯从0价的单质氯变成-1价的NaCl中的氯,得到1mol电子,7.1gCl2为0.1mol,转移0.1NA电子,故C错误;
D.重水是摩尔质量为20g/mol,9g重水的物质的量为:$\frac{9g}{20g/mol}$=0.45mol,1个重水分子含有10个电子,所以只有4.5mol电子,即4.5NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意烷烃结构特点.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
7.W、X、Y、Z均为短周期主族元素.Y的原子序数是W和Z的原子序数之和的一半,且其原子的最外层电子数与核外电子总数之比为2:7,W和Z形成的可溶性化合物WZ溶于水不能促进水的电离,W、X、Z三种元素形成的某种常见化合物M能消毒,下列说法正确的是( )
| A. | Y与Z形成的化合物中含 有离子键 | |
| B. | W、X、Z的简单离子中半径最大的是W | |
| C. | M的水溶液呈碱性 | |
| D. | 1molW单质与足量X单质反应,转移电子物质的量可能是2mol,也可能是1mol |
8.化学与人们的生活、健康密切相关.下列做法不合理的是( )
| A. | 用米汤检验加碘食盐中的碘酸钾(KIO3) | |
| B. | 向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐 | |
| C. | 用灼烧和闻气味的方法区别棉织物和纯毛织物 | |
| D. | 用透析的手段净化尿毒症患者的血液 |
5.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$ KIO3+3H2↑.下列有关说法正确的是( )
| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O=IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产有利 | |
| D. | 电解前后溶液的pH几乎不变 |
12.下列各组物质在溶液中起反应时,离子方程式相同的是( )
| A. | 氯化钡与硫酸钠,氢氧化钡与硫酸 | |
| B. | 碘化钾与氯气,溴化钾与氯气 | |
| C. | 碳酸银与盐酸,硝酸银与盐酸 | |
| D. | 碳酸氢钠与稀硫酸,碳酸氢钾与盐酸 |
9.下列关于仪器的识别中错误的是( )
| A. | 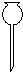 分液漏斗 | B. |  蒸发皿 | C. |  坩埚钳 | D. | 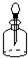 滴瓶 |
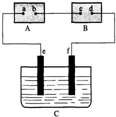 图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点显红色.试回答:
图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点显红色.试回答: