题目内容
14.硝化甘油(C3H5N3O9)分解时产物为N2、CO2、O2和H2O,它的分解反应方程式为4C3H5N3O9=6N2+12CO2+O2+10H2O,已知20℃时,2.27硝化甘油分解放出15.4kJ的热量,写出其对应的热化学方程式4C3H5N3O9 (l)=6N2(g)+12CO2(g)+O2(g)+10H2O(l)△H=-6160KJ/mol.分析 利用观察法配平方程式;根据方程式可知,每摩尔硝化甘油分解产生的气体,由此计算出0.1mol硝化甘油分解产生气体,根据已知,可求出生成1mol气体放出的热量,根据2.27g硝化甘油分解放出热量为15.4kJ,可列比例计算454Kg的硝化甘油分解放出的热量,结合热化学方程式书写方法写出.
解答 解:硝化甘油(C3H5N3O9)分解时产物为N2、CO2、O2和H2O,配平方程式得:4C3H5N3O9$\frac{\underline{\;\;△\;\;}}{\;}$6N2+12CO2+O2+10H2O;硝化甘油的摩尔质量为227g/mol,
2.27g硝化甘油的物质的量为$\frac{2.27g}{227g/mol}$=0.01mol,放出15.4KJ能量,
4mol硝化甘油(C3H5N3O9)分解时放出热量=$\frac{15.4×4}{0.01}$KJ=6160KJ,
反应的热化学方程式为:4C3H5N3O9 (l)=6N2(g)+12CO2(g)+O2(g)+10H2O(l)△H=-6160KJ/mol,
故答案为:4C3H5N3O9=6N2+12CO2+O2+10H2O;4C3H5N3O9 (l)=6N2(g)+12CO2(g)+O2(g)+10H2O(l)△H=-6160KJ/mol.
点评 本题考查了化学方程式书写,热化学方程式的书写方法应用,主要是反应过程中热量的计算分析,题目较简单.

练习册系列答案
相关题目
5.下列反应中,反应物的量的相对多少都会影响反应产物,下列离子方程式正确的是( )
| A. | 少量CO2通入过量氨水中:NH3•H2O+CO2=${NH}_{4}^{+}$+${HCO}_{3}^{-}$ | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合加热:${HSO}_{3}^{-}$+OH-=${SO}_{3}^{2-}$+H2O | |
| C. | 溴化亚铁溶液中通入少量Cl2:Cl2+2Br-=2Cl-+Br2 | |
| D. | 含1mol KOH的溶液与含2mol Ba(HCO3)2的溶液混合:Ba2++${2HCO}_{3}^{-}$+2OH-=BaCO3↓+${CO}_{3}^{2-}$+2H2O |
9.断裂以下的物质需要能量最多的是( )
| A. | HCl | B. | HBr | C. | HI | D. | HAt |
6.1mol下列气体中所含原子数最多的是( )
| A. | H2 | B. | CO2 | C. | CH4 | D. | O2 |
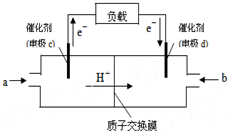
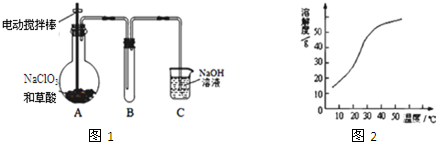
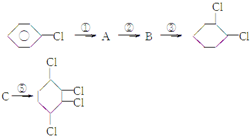
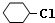 ,B:
,B: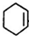 ,C:
,C: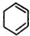 .
.