题目内容
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000molL﹣1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 .
(2)盛装标准盐酸的仪器名称为 .
(3)滴定至终点的颜色变化为 .
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 . 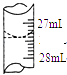
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字).
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL﹣1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
① | 25.00 | 0.00 | 26.29 |
② | 25.00 | 1.00 | 31.00 |
③ | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
【答案】
(1)锥形瓶
(2)酸式滴定管
(3)溶液由黄色变为橙色且半分钟内不褪色
(4)26.90mL
(5)0.1052mol/L
(6)A,C
【解析】解:(1)用酸式滴定管取待测待测NaOH溶液于锥形瓶中;
所以答案是:锥形瓶;
(2)盛装标准盐酸的仪器名称为酸式滴定管;
所以答案是:酸式滴定管;
(3)待测液是氢氧化钠,锥形瓶中盛有的氢氧化钠溶液中滴入甲基橙,溶液的颜色是黄色,随着溶液的pH减小,当滴到溶液的pH小于4.4时,溶液颜色由黄色变成橙色,且半分钟不褪色,滴到结束,
所以答案是:溶液由黄色变为橙色且半分钟内不褪色;
(4)甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图为27.40ml,滴定管中的液面读数为27.40ml﹣0.50mL=26.90mL,
所以答案是:26.90mL;
(5)根据数据的有效性,舍去第2组数据,则1、3组平均消耗V(盐酸)= ![]() =26.30mL,
=26.30mL,
HCl+ | NaOH═NaCl+H2O |
0.0263L×0.1000molL﹣1 | 0.025L×C(NaOH) |
则C(NaOH)= ![]() =0.1052mol/L;
=0.1052mol/L;
所以答案是:0.1052mol/L;(6)A.锥形瓶用蒸馏水洗净后再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)= ![]() 分析,造成c(待测)偏高,故A正确;
分析,造成c(待测)偏高,故A正确;
B.酸式滴定管用蒸馏水洗净后再用标准液润洗,对V(标准)无影响,根据c(待测)= ![]() 分析,造成c(待测)不变,故B错误;
分析,造成c(待测)不变,故B错误;
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,根据c(待测)= ![]() 分析,造成c(待测)偏高,故C正确;
分析,造成c(待测)偏高,故C正确;
D.滴定前读数正确,滴定后俯视滴定管读数,会造成V(标准)偏小,根据c(待测)= ![]() 分析,造成c(待测)偏低,故D错误;
分析,造成c(待测)偏低,故D错误;
故选AC.
【考点精析】根据题目的已知条件,利用酸碱中和滴定的相关知识可以得到问题的答案,需要掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

【题目】三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10﹣18 | 1.3×10﹣36 | 2.5×10﹣13 |
下列有关说法中正确的是( )
A.25℃时,CuS的溶解度大于MnS的溶解度
B.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10﹣36 molL﹣1
C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+ , 可以选用FeS作沉淀剂