题目内容
【题目】三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10﹣18 | 1.3×10﹣36 | 2.5×10﹣13 |
下列有关说法中正确的是( )
A.25℃时,CuS的溶解度大于MnS的溶解度
B.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10﹣36 molL﹣1
C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+ , 可以选用FeS作沉淀剂
【答案】D
【解析】A.当化学组成相似时,Ksp与溶解度成正比,FeS的Ksp=6.3×10﹣18,MnS的Ksp=2.5×10﹣13,所以FeS的溶解度小于MnS的溶解度,故A不符合题意;
B.CuS的Ksp=c(Cu2+)×c(S 2﹣) 求得c(Cu2+)= ![]() ×10﹣18mol/L.故B不符合题意;
×10﹣18mol/L.故B不符合题意;
C.CuS是难溶于水又难溶于强酸的固体,所以可以发生,故C不符合题意,
D.因为FeS的Ksp=6.3×10﹣18,CuS的Ksp=1.3×10﹣36所以加入FeS可以转化为更难溶的CuS沉淀,故D符合题意;
所以答案是:D.

 阅读快车系列答案
阅读快车系列答案【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000molL﹣1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 .
(2)盛装标准盐酸的仪器名称为 .
(3)滴定至终点的颜色变化为 .
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 . 
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字).
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL﹣1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
① | 25.00 | 0.00 | 26.29 |
② | 25.00 | 1.00 | 31.00 |
③ | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
【题目】(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为__________________________。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
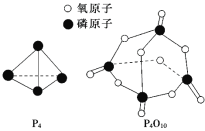
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如下图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。
(II)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
请回答下列问题:
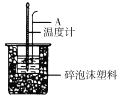
(3)A的仪器名称为_____________。
(4)如下图所示,泡沫塑料板上面有两个小孔,两个小孔不能开得过大,其原因是____________;反应需要测量温度,每次测量温度后都必须采取的操作是____________________。
(5)某学生实验记录数据如下:
实验序号 | 起始温度t1 ℃ | 终止温度t2 ℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
已知盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(6)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。