��Ŀ����
����Ŀ������-����ື����Ǽ������ڼ�ȩ(��ѧʽCH2O)�����ij��÷���֮һ����ѧѧϰС��������ԭ���������װ�òⶨ��װ�����ڿ����м�ȩ�ĺ�����(�г�װ����ȥ)

��֪����ȩ�ܱ�������Һ������KMnO4��������CO2��10-5mol��L-1����ɫKMnO4��Һ����ȩ���弴��ɫ��ëϸ���ھ�������1mm��
��ش��������⣺
(1)������Һ���Ʊ�����K3����Һ©��������������ʳ��ˮ��������Բ����ƿ�С�����ʳ��ˮ��������_________________________�����۲쵽������ƿ��__________ʱ���ر�K3�ͷ�Һ©��������
(2)���ڿ����м�ȩ�����IJⶨ
������ˮԡ����������ƿ����K1���������������������Ҷ˳鵽����ˣ�����1L���ڿ������ر�K1����K2�������ƶ��������壬������ȫ���Ƴ����ر�K2��װ����ëϸ�ܵ�������______________��
���ظ����������ĴΡ�
�����ַ�Ӧ�����Һ�м���ϡ���������ҺpH=1���ټ�������Fe2(SO4)3��Һ��д������Fe2(SO4)3��Һ������Ӧ�����ӷ���ʽ______________________________�������������ຣ�Fe2+�������γ���ɫ���ʣ���562nm���ⶨ����ȣ��������Fe2+ 1.12mg�������м�ȩ�ĺ���Ϊ___________mg��L-1��
(3)�ر�K3����������ƿ�е���Һ��Ϊ40��00mL 10-4mol�� L-1��KMnO4��Һ����ȡKMnO4��Һʹ�õ�������_____________���ټ���2mL 6mol��L-1�������ữ�����²ⶨ�����м�ȩ�ĺ�����������ƿ����Һǡ����ɫʱ��������A�й�����________�Ρ�
���𰸡� ����ʳ��ˮ�͵���þ��Ӧ�Ʊ���������������Ӧ���� ��ɫ����ǡ���ܽ�ʱ ��С�����ͨ���ٶȣ�ʹ�����м�ȩ���屻��ȫ���� Ag+Fe3+=Ag++ Fe2+ 0.03 ��ʽ�ζ��ܻ���Һ�� 5
��������(1)����ʳ��ˮ�͵���þ��Ӧ�Ʊ���������������Ӧ���ʣ���ˮ��Һ����������Һ��Ӧ���Ȳ�����ɫ�����������ܽ⣬���۲쵽������ƿ�а�ɫ����ǡ���ܽ�ʱ���ر�K3�ͷ�Һ©����������ȷ�𰸣�����ʳ��ˮ�͵���þ��Ӧ�Ʊ���������������Ӧ���ʣ���ɫ����ǡ���ܽ�ʱ��
(2) ��װ����ëϸ�ܵ������Ǽ�С�����ͨ���ٶȣ�ʹ�����м�ȩ���屻��ȫ���գ���ȷ�𰸣���С�����ͨ���ٶȣ�ʹ�����м�ȩ���屻��ȫ���ա�
�ڼ�ȩ��������Һ���ȷ�Ӧ�������������л�ԭ�ԣ���Fe3+���������ӷ���ʽ��Ag+Fe3+=Ag++ Fe2+�����ݼ�ȩ�ܱ�������Һ����Ϊ������̼��������������������ԭΪ����������ȩ��̼Ԫ�ػ��ϼ���0�ۡ�+4�ۣ�����+1�ۡ�0�ۣ����ɵ����ֱ������������������ӱ����ֱ���ԭΪ�������ӣ�����Fe2+1.12mg�����ʵ���Ϊ2��10-5mol�����ݵ����غ���ɣ������ļ�ȩ����Ϊxmol����4x=2��10-5��1��x=5��10-6mol�����ʵ�������5�β��������Բ��1L�����м�ȩ�ĺ���Ϊ1��10-6mol,��Ϊ1��10-6��30��103=0.03 mg��L-1����ȷ�𰸣�Ag+Fe3+=Ag++ Fe2+��0.03��
(3)�������Ը��������Һ����ǿ�����ԣ��ܹ���ʴ�����Ҫ����ʽ�ζ��ܻ���Һ�ܽ�����ȡ����֪1L�����м�ȩ�ĺ���Ϊ1��10-6mol������KMnO4��Һ����Ϊ������̼��KMnO4����ԭΪ�����ӣ���������A�й�����N��, n(KMnO4)=40��10-3��10-4=4��10-6 mol�����ݵ����غ���ɣ�N��4��1��10-6=4��10-6����7-2����N=5����ȷ�𰸣���ʽ�ζ��ܻ���Һ�ܣ�5��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����ⶨijNaOH��Һ�����ʵ���Ũ�ȣ�����0.1000molL��1��HCl����Һ�����к͵ζ����ü�����ָʾ������
��ش��������⣺
��1���ζ�ʱ��ʢװ����NaOH��Һ����������Ϊ ��
��2��ʢװ���������������Ϊ ��
��3���ζ����յ����ɫ�仯Ϊ ��
��4������ѧ����ʵ������У���¼�ζ�ǰ�ζ�����Һ�����Ϊ0.50mL���ζ���Һ����ͼ�����ʱ���ı���Һ�����Ϊ �� 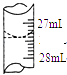
��5����ѧ����������ƽ��ʵ�飬���ݼ�¼���£�
ѡȡ�����������ݣ����������NaOH��Һ�����ʵ���Ũ��Ϊ ��������λ��Ч���֣���
ʵ����� | ����NaOH��Һ�����/mL | 0.1000molL��1HCl��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
�� | 25.00 | 0.00 | 26.29 |
�� | 25.00 | 1.00 | 31.00 |
�� | 25.00 | 1.00 | 27.31 |
��6��������Щ������ʹ�ⶨ���ƫ��������ţ���
A.��ƿ������ˮϴ�������ô���Һ��ϴ
B.��ʽ�ζ���������ˮϴ�������ñ�Һ��ϴ
C.�ζ�ǰ��ʽ�ζ��ܼ������δ�ų����ζ���������ʧ
D.�ζ�ǰ������ȷ���ζ����ӵζ��ܶ�����
����Ŀ��ú����Ҫ���Ԫ����̼���⡢��������ȼú����CxHy��SO2�ȴ�����Ⱦ�ú�������Ǹ�Ч���������ú̿����Ҫ;��֮һ���ش���������:
��1������ú��������õ�ˮú��( ��Ҫ�ɷ�ΪCO��CO2��H2 )�ڴ��������¿��Ժϳ���ɫȼ�ϼ״���
��֪: H2O(1) = H2O(g) ��H1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(g) ��H2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ��H3=-58.7 kJ/mol
д����CO��H2�Ʊ�CH3OH ������Ȼ�ѧ����ʽ____________��
��2���״���CO2��ֱ�Ӻϳ�̼�������(CH3OCOOCH3���DMC) ;
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ��H4<0
CH3OCOOCH3(g)+H2O(g) ��H4<0
�ٸû�ѧ��Ӧ��ƽ�ⳣ������ʽΪK=__________
���ں��º����ܱ������з���������Ӧ,��˵����Ӧ�ﵽƽ��״̬����________(����)��
A.V��(CH3OH)= 2V��(H2O)
B.������������ܶȲ���
C.������ѹǿ����
D.CH3OH��CO2�����ʵ���֮�ȱ��ֲ���
��һ�������·ֱ���ף��ҡ������������ܱ������м���һ�����ij�ʼ���ʷ����÷�Ӧ�����������¶ȡ���Ӧ�����ʼ�����±�����Ӧ������DMC�����ʵ���Ũ����ʱ��仯��ͼ��ʾ:
���� | �� | �� | �� |
�ݻ�(L) | 0.5 | 0.5 | V |
�¶�(��) | T1 | T2 | T3 |
��ʼ�� | 1molCO2(g) 2molCH3OH(g) | 1molDMC(g) 1molH2O(g) | 2molCO2(g) 2molCH3OH(g) |
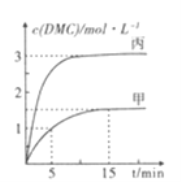
�������У���5-15minʱ��ƽ����Ӧ����v(CO2)=___________.�������У���ƽ��ʱn(CO2)=0.2mol.��T1_____T2 (����>����<������=��)���������ķ�Ӧ��ƽ��ʱCO2��ת����: ��________��(����>����<."����=��)��
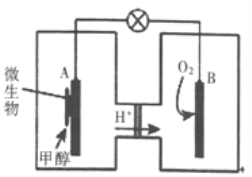
��3�����ü״����Ƴ�����ȼ�ϵ��(�������ォ��ѧ��ֱ��ת���ɵ��ܵ�װ��)��ij����ȼ�ϵ��װ����ͼ��ʾ: A����_____��(����������������)����缫��Ӧʽ��_______���õ�ز����ڸ����¹�����������________��