题目内容
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的佛点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
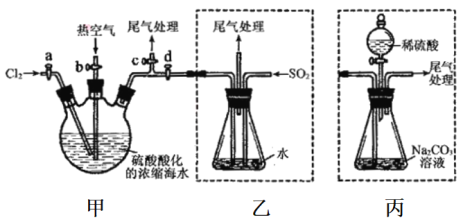
①连接甲与乙,关闭活案b、d,打开活案a、c,向甲中缓慢通入Cl2至反应结束。
②关闭a、c,打开b、d,向甲中鼓入足量热空气。
③进行步骤②的同时,向乙中通入足量SO2。
④关闭b,打开a,再通过甲向乙中级慢通入足量Cl2。
⑤将乙中所得液体进行蒸馏,收集液溴。
请回答:
(1)步骤②中鼓入热空气作用为____________。
(2)步骤③中发生的主要反应的离子方程式为___________。
(3)此实验中尾气可用____(填选项字母)吸收处理。
A.水 B.饱和Na2CO3溶液 C.NaOH溶液 D.饱和NaCl溶液
(4)若直接连接甲与丙进行步骤①和②,充分反应后,向维形瓶中满加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,丙中反应生成了NaBrO3等,该反应的化学方程式为______。
(5)与乙装置相比,采用丙装置的优点为________________。
【答案】 吹出反应中生成的Br2 Br2+SO2+2H2O=4H++2Br-+SO42- BC 3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑ 步骤少,减少了二氧化硫的污染,操作简便
【解析】(1)溴易挥发,热空气可使溴蒸气进入乙中;
(2)步骤③中,向乙中通入足量SO2,与溴发生氧化还原反应生成硫酸、HBr;
(3)尾气含SO2、Br2,均与碱液反应;
(4)丙中反应生成了NaBrO3,可知Br元素的化合价升高,则还应生成NaBr;
(5)丙比乙更容易操作,尾气处理效果好。
(1)步骤②中鼓入热空气的作用为使甲中生成的Br2随空气流进入乙中,即步骤②中鼓入热空气的作用是吹出反应中生成的Br2;
(2)二氧化硫具有还原性,能被溴水氧化,则步骤③中发生的主要反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)尾气含SO2、Br2,均与碱液反应,则选碳酸钠溶液或NaOH溶液吸收尾气,答案为BC;
(4)丙中反应生成了NaBrO3,可知Br元素的化合价升高,因此还应生成NaBr,且酸与碳酸钠反应生成二氧化碳,该反应的方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑;
(5)与乙装置相比,采用丙装置的优点为步骤少,减少了二氧化硫的污染,且操作简便。

 名校课堂系列答案
名校课堂系列答案【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000molL﹣1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 .
(2)盛装标准盐酸的仪器名称为 .
(3)滴定至终点的颜色变化为 .
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 . 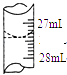
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字).
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL﹣1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
① | 25.00 | 0.00 | 26.29 |
② | 25.00 | 1.00 | 31.00 |
③ | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.