��Ŀ����
����Ŀ���������(SiHCl3)���Ʊ����顢�ྦྷ�����Ҫԭ�ϡ��ش��������⣺
(1)SiHCl3�ڴ��������·�����Ӧ��
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ��H1=48 kJ��mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ��H2=30 kJ��mol-1
��Ӧ4SiHCl3(g)=SiH4(g)+3SiCl4(g)�Ħ�H=__________kJ��mol-1��
(2)���ڷ�Ӧ2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)�����ô�������������ӽ�����֬��������323K��343KʱSiHCl3��ת������ʱ��仯�Ľ����ͼ��ʾ��
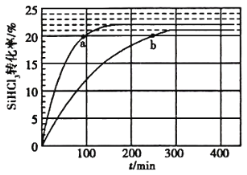
�� 343Kʱ��Ӧ��ƽ��ת���ʦ�=__________%��ƽ�ⳣ������ʽ__________��
����343K�£�Ҫ���SiHCl3ת���ʣ��ɲ�ȡ�Ĵ�ʩ��__________��Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬�ɲ�ȡ�Ĵ�ʩ��__________��__________��
�۱Ƚ�a��b����Ӧ���ʴ�С��va__________vb(����ڡ���С�ڡ����ڡ�)��
���𰸡�+114 22 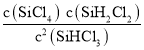 ��ʱ��������� ����ѹǿ ʹ�ô����� ����
��ʱ��������� ����ѹǿ ʹ�ô����� ����
��������
(1)SiHCl3�ڴ��������·�����Ӧ��
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ��H1=48 kJ��mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ��H2=30 kJ��mol-1
�ѵ�һ����Ӧ����3��͵ڶ�����Ӧ��ӣ����ɵ÷�Ӧ4SiHCl3(g)=SiH4(g)+3SiCl4(g)������H=3��H1+��H2=3��48 kJ��mol-1+(30 kJ��mol-1)=+144kJ��mol-1��
(2) ���¶�Խ�ߣ���Ӧ����Խ�죬Խ�ȴﵽƽ�⣬����ͼ����a�����ڵ������¶ȸߣ���Ϊ343K�µ����ߡ������߿��Կ�����ƽ��ʱSiHCl3��ת����Ϊ22%��ƽ�ⳣ��Ϊƽ��ʱ������Ũ����֮�����Է�Ӧ��Ũ����֮�����ʷ�Ӧ2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)��ƽ�ⳣ������ʽΪK=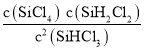 ���ʴ�Ϊ22��
���ʴ�Ϊ22�� ��
��
����343K�£�Ҫ���SiHCl3ת���ʣ���Ҫʹƽ�������ƶ���Ӱ��ƽ���������Ũ�ȡ��¶ȡ�ѹǿ�ȣ������¶�һ�������÷�Ӧ��ǰ������ϵ������ȣ�ѹǿ�ı䲻��ʹƽ���ƶ�������ֻ�ܲ�ȡ��ʱ�������Ĵ�ʩ����߷�Ӧ���ת���ʡ�Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬��Ҫ��߷�Ӧ���ʣ���Ӱ�췴Ӧ���ʵ�����Ũ�ȡ��¶ȡ�ѹǿ�ʹ����ȷ��濼�ǣ��ɲ�ȡ�Ĵ�ʩ������ѹǿ��������Ӧ��Ũ�ȣ���ʹ�ô����ȡ��ʴ�Ϊ����ʱ������������ѹǿ��ʹ�ô����ȡ�
��a��b������Ӧ���ת������ȣ����Ը����ʵ�Ũ����ȣ���a���¶ȸ���b���¶ȣ��¶�Խ�ߣ���Ӧ����Խ�죬���Է�Ӧ���ʣ�va����vb��

����Ŀ��ǰ����������Ԫ��X��Y��M��N����Ϣ���£�
�й���Ϣ | |
X | XԪ�ص�ԭ�������������ǵ��Ӳ�����3�� |
Y | YԪ������������������������֮��Ϊ4��Y��ͬ������ԭ�Ӱ뾶��С��Ԫ�� |
M | �����µ��ʳ�Һ̬�ķǽ���Ԫ�� |
N | N�Ļ�����������ʱ��ɫ�ʻ�ɫ |
��ش��������⣺
(1)MԪ�������ڱ��е�λ��______________________��
(2)YԪ�صļ������ӽṹʾ��ͼ_______________��
(3)������N2X2�ĵ���ʽΪ_______________����д������һ����;_______________��
(4)��Ʒ���֤��M��YԪ�صĵõ�������ǿ����______________________________________��
(5)Y�ĵ�����һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�á�Ϊ̽��Y���ʵ����ʣ�ijͬѧ�������ͼ��ʾ��ʵ��װ�á�
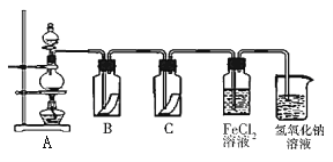
��ʵ������ȡ����Ļ�ѧ����ʽΪ��__________________________________________���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ_________________________
��װ��B��C�����ηŵ��Ǹ���ĺ�ɫ������ʪ��ĺ�ɫ������������װ��_____�еĺ�ɫ������ɫ����ʵ������и�ͬѧ����װ��B��C�еIJ�������ɫ����ԭ�������_________________��
��д����������FeCl2��Һ��Ӧ�����ӷ���ʽ____________________________________��
�ܹ�ҵ�ϳ���ʯ���������Ƹ������Ƶ�Ư�ۣ�Ư�۵ı����ܷⱣ�棬������ʧЧ��ԭ����____(�û�ѧ����ʽ��ʾ)��
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ����,������������Ϣ���ɡ��±����������ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ�(��֪��Ԫ�ص�ԭ�Ӱ뾶Ϊ0.089 nm)��
Ԫ�ش��� | A | B | C | D | X | Y |
ԭ�Ӱ뾶/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
��Ҫ���ϼ� | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
��1��CԪ�������ڱ��е�λ��Ϊ________�������ӽṹʾ��ͼΪ��_______��
��2��B������������Ӧ��ˮ������Y������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ___��
��3������C��D ����Ԫ��˵����ȷ����__________������ţ���
a.�����ӵİ뾶D>C b.��̬�⻯����ȶ���D��Cǿ c.����������Ӧ��ˮ���������C��Dǿ
��4����100mL18mol/L��C������������Ӧ��ˮ�����Ũ��Һ�м��������ͭƬ������ʹ���ַ�Ӧ��������������Ϊ6.72L(����£�����÷�Ӧ������ת�Ƶĵ�����Ϊ______��
��5��д����A��D��X����Ԫ����ɵ�ij�ֿ�������ɱ�����ʵĵ���ʽ_____________��
��6���Ƚ�YԪ������ͬ�������Ԫ�ص��⻯����۷е�ߵ�__ ��___ (���⻯�ﻯѧʽ��������___________��
����Ŀ��������ͼװ��̽��ͭ���������Լ��ķ�Ӧ�����Թ��м���һ����ͭ�ۣ������Լ�����������������ʵ���������±���ʾ�������ƶ�����ȷ����( )
���ϣ�Cu2++4NH3![]() [Cu(NH3)4]2+, [Cu(NH3)4]2+�����ɫ��
[Cu(NH3)4]2+, [Cu(NH3)4]2+�����ɫ��
װ�� | ��� | �Լ� | ���� |
| �� | 10 mLŨNH3��H2O��3 mLH2O | ��Һ��Ϊ���ɫ�����ˮ������ |
�� | 10 mLŨNH3��H2O��3 mL H2O2 | ��Һ��Ϊ���ɫ���ұȢ��� | |
�� | 10 mL 20% HNO3��Һ��3 mL H2O | ��Һ���ٱ�����������ɫ���壬���ˮ���½� | |
�� | 10 mL 20% HNO3��Һ��3 mL H2O2 | ��Һ�����Ȣ�����������ɫ���壬���ˮ���½� |
A.����ʵ������˵��O2�����˷�Ӧ
B.������Һ��ɫ�Ȣ������������H2O2����Cu����Cu2+
C.�������ˮ���½������Ƿ�Ӧ����NO���嵼�µ�
D.�ܱȢ۱�����������H2O2�ֽ������������