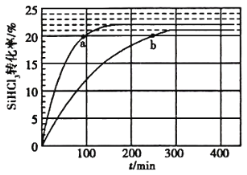
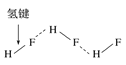
题目内容
【题目】下列说法不正确的是( )
A.Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素
B.在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
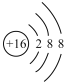
C.某基态原子的核外电子排布图为![]() ,它违背了泡利原理
,它违背了泡利原理
D.某价电子排布为3d14s2的基态原子,该元素位于周期表中第四周期第ⅢB族
【答案】A
【解析】
A. Xe元素位于元素周期表0族,0族元素中氦元素的价电子排布式均为1s2,不是ns2np6,故A错误;
B. 在元素周期表中,s区中除H元素不是金属元素外,其他元素都为金属元素,d区和ds区的元素都是金属,故B正确;
C. 根据泡利原理可知,位于同一轨道的两个电子的自旋方向相反,由核外电子排布图为![]() 可知,它违背了泡利原理,故C正确;
可知,它违背了泡利原理,故C正确;
D. 某价电子排布为3d14s2的基态原子,该元素为Sc元素,位于周期表中第四周期第ⅢB族,故D正确;
故选A。

【题目】锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下:

请回答:
(1)分析步骤 II 中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是______________________, 其中, 可以采用加入_________________________来调节 pH ;
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
pH | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
1 | 114.32 | 0.750 | 0.059 |
2 | 114.4 | 0.086 | 0.056 |
3 | 113.68 | 0.034 | 0.054 |
4 | 113.60 | 0.010 | 0.050 |
5 | 112.43 | 0.010 | 0.050 |
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
温度 (℃) | ZnSO4.7H2O 回收量(g) | 产品中F的含量% | 产品中其他重金属含量% |
20 | 111.45 | 0.011 | 0.052 |
40 | 112.89 | 0.010 | 0.051 |
60 | 113.30 | 0.010 | 0.050 |
80 | 113.80 | 0.010 | 0.050 |
90 | 114.40 | 0.091 | 0.048 |
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式_________________________________________。 若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:_________________________;
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为___________________________;
②如何检验滤液B中是否含有铁元素_____________________________________;
③写出生成滤渣C的离子方程式__________________________________________;
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6 标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6 溶液进行滴定,所得数据如下表:
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 19.92 |
2 | 1.34 | 21.12 |
3 | 0.00 | 20.10 |
则 ZnSO4·7H2O 晶体的纯度是_______________(以质量分数表示,保留到小数点后两位)。