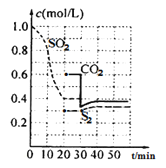
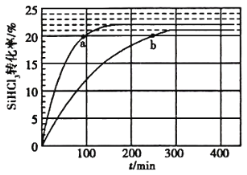
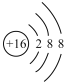
题目内容
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
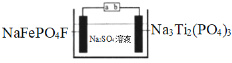
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
【答案】B
【解析】
2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
分析方程式得出NaFePO4F变为Na2FePO4F,Fe在降低,发生还原反应,该物质作原电池的正极,Na3Ti2(PO4)3变为NaTi2(PO4)3,Ti在升高,发生氧化反应,该物质作原电池的负极。
A选项,放电时a为正极,因此充电时,a接电源正极,故A正确;
B选项,放电时,溶液中的Na+不放电,而是Na3Ti2(PO4)3中Ti在失去电子,故B错误;
C选项,阴极主要是NaTi2(PO4)3得到电子,因此阴极上的电极反应为NaTi2(PO4)3+ 2Na+ + 2e- =Na3Ti2(PO4)3,故C正确;
D选项,根据溶液中电荷守恒关系,理论上,该电池在充电或放电过程中溶液中的c(Na+)不变,故D正确;
综上所述,答案为B。

【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。