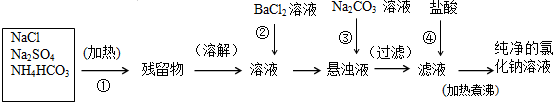
题目内容
17.下列各组液体混合物,用分液漏斗能分开的是( )| A. | 丙三醇和四氯化碳 | B. | 溴乙烷和乙醇 | ||
| C. | 硝基苯和水 | D. | 苯和溴苯 |
分析 能用分液漏斗分离的物质应互不相溶,以此解答.
解答 解:题中丙三醇和四氯化碳、溴乙烷和乙醇以及苯和溴苯都互溶,不能用分液的方法分离,而硝基苯和水互不相溶,可用分液的方法分离.
故选C.
点评 本题考查物质的分离,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
7.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Li,⑧的元素名称是硼.①在元素周期表中的位置是(周期、族)第二周期第VIA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;名称是高氯酸;碱性最强的化合物是:NaOH.
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出实验室制取⑦的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(5)写出⑦的氢化物与①的常见单质在Pt催化下反应的化学方程式:4NH3+5O2$\frac{\underline{\;pt\;}}{△}$4NO+6H2O.
(6)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
回答下列问题:
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;名称是高氯酸;碱性最强的化合物是:NaOH.
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出实验室制取⑦的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(5)写出⑦的氢化物与①的常见单质在Pt催化下反应的化学方程式:4NH3+5O2$\frac{\underline{\;pt\;}}{△}$4NO+6H2O.
(6)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
12.下列离子方程式中,书写正确的是( )
| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 往碳酸钙中滴加稀盐酸:CO32-+2H+=CO2↑+H2O | |
| C. | Na与硫酸铜溶液反应:2Na+Cu2+=Cu+2Na+ | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
7.工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知在25.C时:
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ•mol-1
C(石墨,s)+O2(g)═CO2(g)△H2=-494kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-142kJ•mol-1
则反应CO(g)+H2O(g)═CO2(g)+H2(g)的反应热△H=-241kJ•mol-1(3分)
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①以下反应能说明CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡状态的是a
A.容器中CO的含量保持不变 B.容器中CO2浓度与CO浓度相等
C.ν(CO)正=ν(H2O )正 D.容器中混合气体的平均相对分子质量保持不变
②实验Ⅰ中,从反应开始到反应达到平衡时,CO的平均反应速率ν(CO)=0.16mol/(L.min);;
③实验Ⅱ条件下反应的平衡常数K=0.33(保留小数点后二位).若降低温度,化学平衡常数K将增大(填“增大”“减小”或“不变”).
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是a<b;
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时ν(正)>ν(逆)(填“>”或“<”),平衡向正反应方向移动(填“正反应”“逆反应”“不移动”)
(1)已知在25.C时:
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ•mol-1
C(石墨,s)+O2(g)═CO2(g)△H2=-494kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-142kJ•mol-1
则反应CO(g)+H2O(g)═CO2(g)+H2(g)的反应热△H=-241kJ•mol-1(3分)
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 超始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| 3 | 900 | a | b | c | d | t |
A.容器中CO的含量保持不变 B.容器中CO2浓度与CO浓度相等
C.ν(CO)正=ν(H2O )正 D.容器中混合气体的平均相对分子质量保持不变
②实验Ⅰ中,从反应开始到反应达到平衡时,CO的平均反应速率ν(CO)=0.16mol/(L.min);;
③实验Ⅱ条件下反应的平衡常数K=0.33(保留小数点后二位).若降低温度,化学平衡常数K将增大(填“增大”“减小”或“不变”).
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是a<b;
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时ν(正)>ν(逆)(填“>”或“<”),平衡向正反应方向移动(填“正反应”“逆反应”“不移动”)
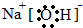 .
.
 ;
;