题目内容
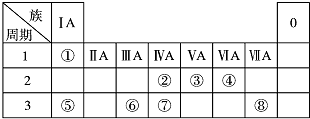
7.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.回答下列问题:
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;名称是高氯酸;碱性最强的化合物是:NaOH.
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出实验室制取⑦的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(5)写出⑦的氢化物与①的常见单质在Pt催化下反应的化学方程式:4NH3+5O2$\frac{\underline{\;pt\;}}{△}$4NO+6H2O.
(6)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
分析 ①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,且③的原子半径不是所有元素中最小的,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl;⑧只有最高价+3,处于ⅢA族,原子半径小于P,故⑧为B,据此解答.
解答 解:①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,且③的原子半径不是所有元素中最小的,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl;⑧只有最高价+3,处于ⅢA族,原子半径小于P,故⑧为B.
(1)由上述分析可知,③的元素符号是Li,⑧的元素名称是硼,①为O元素,在元素周期表中的位置是第二周期第VIA族,故答案为:Li;硼;第二周期第VIA族;
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,名称是高氯酸;上述元素中Na的金属性最强,碱性最强的化合物是:NaOH,
故答案为:HClO4;高氯酸;NaOH;
(3)④为P、⑦为N,二者同主族,电子层越多非金属性越弱,故非金属性N>P,则氢化物稳定性NH3>PH3,故答案为:NH3>PH3;
(4)⑦的氢化物为NH3,实验室制备氨气的反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(5)氨气与氧气在Pt催化下反应的化学方程式:4NH3+5O2$\frac{\underline{\;pt\;}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;pt\;}}{△}$4NO+6H2O;
(6)②最高价氧化物对应水化物为Mg(OH)2,⑤的氢化物水溶液为盐酸,二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O.
点评 本题考查结构性质位置关系应用,侧重于学生的分析能力的考查,难度中等,关键是根据化合价与原子半径推断元素,注意元素周期律的理解掌握.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | NH4HCO3溶液中加入过量的NaOH溶液并加热:HCO3-+OH+$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+H2O | |
| C. | 稀硝酸除银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2═2Fe3++H2O |

| A. | 图中所有的反应均为氧化还原反应 | |
| B. | 反应①②均为离子反应 | |
| C. | 反应②③都能产生氢气,且产生等量氢气消耗Al的质量和转移电子数分别相等 | |
| D. | 反应①②⑦中铝均作还原剂 |
| A. | 元素非金属性按X、Y、Z的顺序减弱 | |
| B. | 单质的氧化性按X、Y、Z的顺序增强 | |
| C. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序增强 |
| A. | 丙三醇和四氯化碳 | B. | 溴乙烷和乙醇 | ||
| C. | 硝基苯和水 | D. | 苯和溴苯 |
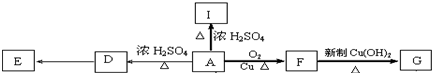 .
.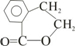 E
E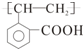 ;
;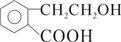 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2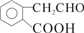 +2H2O
+2H2O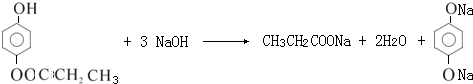 .
. 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: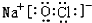 .
.