题目内容
7.工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)(1)已知在25.C时:
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ•mol-1
C(石墨,s)+O2(g)═CO2(g)△H2=-494kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-142kJ•mol-1
则反应CO(g)+H2O(g)═CO2(g)+H2(g)的反应热△H=-241kJ•mol-1(3分)
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 超始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| 3 | 900 | a | b | c | d | t |
A.容器中CO的含量保持不变 B.容器中CO2浓度与CO浓度相等
C.ν(CO)正=ν(H2O )正 D.容器中混合气体的平均相对分子质量保持不变
②实验Ⅰ中,从反应开始到反应达到平衡时,CO的平均反应速率ν(CO)=0.16mol/(L.min);;
③实验Ⅱ条件下反应的平衡常数K=0.33(保留小数点后二位).若降低温度,化学平衡常数K将增大(填“增大”“减小”或“不变”).
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是a<b;
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时ν(正)>ν(逆)(填“>”或“<”),平衡向正反应方向移动(填“正反应”“逆反应”“不移动”)
分析 (1)①C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ•mol-1
②C(石墨,s)+O2(g)═CO2(g)△H2=-494kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-142kJ•mol-1
根据盖斯定律②-①-③计算得到;
(2)①化学平衡的标志是正逆反应速率相同,个组分含量保持不变,衍生的条件满足变量不变的原则分析判断;
②反应速率V=$\frac{△c}{△t}$计算得到;
③根据实验Ⅱ条件下反应的平衡常数K=$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$进行计算;根据该反应为放热反应,降低温度,化学平衡向放热反应方向移动,据此分析;
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,反应比相同所以起始量一氧化碳小于水;
⑤计算浓度商和平衡常数比较分析判断反应进行的方向;
解答 解:(1)①C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ•mol-1
②C(石墨,s)+O2(g)═CO2(g)△H2=-494kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-142kJ•mol-1
根据盖斯定律②-①-③得,CO(g)+H2O(g)═CO2(g)+H2(g)△H=-494+111+142=-241kJ•mol-1,故答案为:-241kJ•mol-1;
(2)①a.容器中CO的含量保持不变,说明正逆反应速率相等,达到了平衡状态,故a正确;
b.容器中CO2浓度与CO浓度相等,无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故b错误;
c.ν(CO)正=ν(H2O )正,表示的都是正反应速率,不能说明正逆反应速率相等,无法判断是否达到了平衡状态,故c错误;
d.反应前后气体的物质的量不变,气体的质量也不变,则容器中混合气体的平均相对分子质量一直保持不变,无法判断平衡状态,故d错误;
故答案为:a;
②实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率等于二氧化碳表示的反应速率=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol/(L•min),
故答案为:0.16mol/(L.min);
③根据实验Ⅱ数据,得出平衡时一氧化碳和水的物质的量分别为2-0.5=1.5mol,1-0.5=0.5mol,所以平衡常数K=$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$=$\frac{0.5×0.5}{1.5×0.5}$=0.33;又该反应为放热反应,降低温度,化学平衡向放热反应方向即正反应方向移动,所以K将增大,故答案为:0.33;增大;
④实验Ⅲ中,一氧化碳和和水蒸气反应比相同,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是a<b;
故答案为:a<b;
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,浓度商Q=$\frac{0.2×0.5}{1×0.5}$=0.2<K,
则此时v(正)>v(逆),平衡正向进行;
故答案为:>,正反应.
点评 本题考查了化学平衡的分析计算,主要是影响平衡因素,平衡常数、转化率概念计算,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 丙三醇和四氯化碳 | B. | 溴乙烷和乙醇 | ||
| C. | 硝基苯和水 | D. | 苯和溴苯 |
| 元素 | X | Y | Z | W | R |
| 相 关 信 息 | 能形成+7价的化合物 | 日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子,它是空气的主要成分之一 | 焰色反应为黄色 | 位于第ⅣA族,是形成化合物种类最多的元素 |
(1)X在周期表中的位置是第三周期ⅦA族
(2)用电子式表示W2O的形成过程

(3)Z的基态原子核外电子排布式是1s22s22p3
(4)R、Z两元素的简单氢化物,沸点由高到低的顺序是NH3>CH4(用化学式表示)
(5)含Y的某化合物可用作净水剂,其原因是(用离子方程式表示)Al3++3H2O=Al(OH)3(胶体)+3H+.
| A. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L | |
| B. | 2.3 g Na被O2完全氧化时,失去电子数为0.1NA | |
| C. | 2 L 1 mol•L-1的盐酸中所含氯化氢分子数约为2NA | |
| D. | 标准标况下,5.6 L CCl4含有的分子数为0.25NA |
| A. | 氯离子的结构示意图: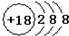 | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: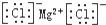 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
| A. | ①③ | B. | ②③ | C. | ①② | D. | ②④ |
| A. | 将水加热使KW增大、pH<7 | |
| B. | 由水电离的c(H+)=10-10 mol•L-1的溶液 | |
| C. | 加水稀释除H+浓度增大外其它粒子浓度降低的溶液 | |
| D. | 非电解质溶于水得到的溶液 |
| A. | Fe2O3 | B. | NaCl | C. | Cu2S | D. | Al2O3 |