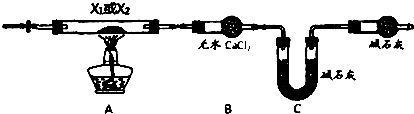
题目内容
6.实验室里需要纯净的氯化钠溶液,但现只有含硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案提纯: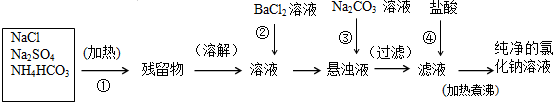
写出有关反应的化学方程式:
第①步NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O
第②步BaCl2+Na2SO4=BaSO4↓+2NaCl
第③步Na2CO3+BaCl2═BaCO3↓+2NaCl
第④步Na2CO3+2HCl═2NaCl+CO2↑+H2O.
分析 操作①是固体加热除去碳酸氢铵,为碳酸氢铵受热分解生成氨气、二氧化碳和水;
操作②为氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠;
操作③加入碳酸钠溶液,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;
操作④加入盐酸除去多余的碳酸钠,加热煮沸溶液的目的是除去滤液中溶解的CO2和多余的盐酸.
解答 解:第①步:氯化钠、硫酸钠热稳定好,碳酸氢铵受热分解:反应的化学方程式为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O,
故答案为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O;
第②步:氯化钠、硫酸钠为残留物,加入氯化钡,氯化钡与硫酸钠反应:化学方程式为BaCl2+Na2SO4=BaSO4↓+2NaCl,
故答案为:BaCl2+Na2SO4=BaSO4↓+2NaCl;
第③步:悬浊液成分为氯化钡、硫酸钡沉淀、氯化钠,加入碳酸钠,碳酸钠与过量的氯化钡反应,化学方程式为Na2CO3+BaCl2═BaCO3↓+2NaCl,
故答案为:Na2CO3+BaCl2═BaCO3↓+2NaCl;
第④步:加入盐酸除去多余的碳酸钠,反应为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,
故答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O.
点评 本题考查了物质除杂的实验方法,除杂问题是化学实验中的一类重要问题,除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,题目难度不大.

练习册系列答案
相关题目
16.已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
| A. | 元素非金属性按X、Y、Z的顺序减弱 | |
| B. | 单质的氧化性按X、Y、Z的顺序增强 | |
| C. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序增强 |
17.下列各组液体混合物,用分液漏斗能分开的是( )
| A. | 丙三醇和四氯化碳 | B. | 溴乙烷和乙醇 | ||
| C. | 硝基苯和水 | D. | 苯和溴苯 |
11.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| B. | 20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
18.X~R是元素周期表中的短周期元素,其相应信息如下表:
请用化学用语回答下列问题:
(1)X在周期表中的位置是第三周期ⅦA族
(2)用电子式表示W2O的形成过程
(3)Z的基态原子核外电子排布式是1s22s22p3
(4)R、Z两元素的简单氢化物,沸点由高到低的顺序是NH3>CH4(用化学式表示)
(5)含Y的某化合物可用作净水剂,其原因是(用离子方程式表示)Al3++3H2O=Al(OH)3(胶体)+3H+.
| 元素 | X | Y | Z | W | R |
| 相 关 信 息 | 能形成+7价的化合物 | 日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子,它是空气的主要成分之一 | 焰色反应为黄色 | 位于第ⅣA族,是形成化合物种类最多的元素 |
(1)X在周期表中的位置是第三周期ⅦA族
(2)用电子式表示W2O的形成过程

(3)Z的基态原子核外电子排布式是1s22s22p3
(4)R、Z两元素的简单氢化物,沸点由高到低的顺序是NH3>CH4(用化学式表示)
(5)含Y的某化合物可用作净水剂,其原因是(用离子方程式表示)Al3++3H2O=Al(OH)3(胶体)+3H+.
15.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L | |
| B. | 2.3 g Na被O2完全氧化时,失去电子数为0.1NA | |
| C. | 2 L 1 mol•L-1的盐酸中所含氯化氢分子数约为2NA | |
| D. | 标准标况下,5.6 L CCl4含有的分子数为0.25NA |
16.下列溶液呈中性的是( )
| A. | 将水加热使KW增大、pH<7 | |
| B. | 由水电离的c(H+)=10-10 mol•L-1的溶液 | |
| C. | 加水稀释除H+浓度增大外其它粒子浓度降低的溶液 | |
| D. | 非电解质溶于水得到的溶液 |