题目内容
5.下列各题中的物质均由核电荷数为1~10的元素组成.请按下列要求填写化学式:(1)只有2个原子核和2个电子构成的分子是H2
(2)1个最外层有5个电子和3个只有1个电子的原子结合的分子是NH3
(3)1个最外层有4个电子的原子和2个最外层有6个电子的原子结合的分子是CO2
(4)由3个最外层是6个电子的原子结合而形成的分子是O3
(5)由2个原子核10个电子结合而成的分子是HF
(6)由5个原子核10个电子结合而成的分子是CH4.
分析 根据前10号元素的电子排布,由成键特点和形成分子的原子数目推导常见的分子微粒;根据原子符号的含义解题.
解答 解:(1)由题意可知,一个原子中含有一个电子,则原子为H,故答案为:H2;
(2)由核外电子排布和形成分子的原子数目可知,原子分别是N和H,形成的分子为NH3,故答案为:NH3;
(3)由由核外电子排布和形成分子的原子数目可知,原子分别是C和O,形成的分子为CO2,故答案为:CO2;
(4)由核外电子排布和形成分子的原子数目可知,原子是O,形成的分子为O3,故答案为:O3;
(5)由核外电子排布和形成分子的原子数目可知,该分子为HF,故答案为:HF;
(6)由核外电子排布和形成分子的原子数目可知,该分子为CH4,故答案为:CH4.
点评 本题考查分子、原子、离子,掌握前10号元素的电子排布情况,由成键特点和形成分子的原子数目推导常见分子微粒的关键.

练习册系列答案
相关题目
16.已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
| A. | 元素非金属性按X、Y、Z的顺序减弱 | |
| B. | 单质的氧化性按X、Y、Z的顺序增强 | |
| C. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序增强 |
17.下列各组液体混合物,用分液漏斗能分开的是( )
| A. | 丙三醇和四氯化碳 | B. | 溴乙烷和乙醇 | ||
| C. | 硝基苯和水 | D. | 苯和溴苯 |
15.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L | |
| B. | 2.3 g Na被O2完全氧化时,失去电子数为0.1NA | |
| C. | 2 L 1 mol•L-1的盐酸中所含氯化氢分子数约为2NA | |
| D. | 标准标况下,5.6 L CCl4含有的分子数为0.25NA |

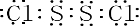 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH. 2SO3(g)△H=-197KJ/mol.
2SO3(g)△H=-197KJ/mol.