题目内容
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心e处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体上滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O)
(1)e处反应的离子方程式为_____________________,该反应中发生反应的氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象为________________,d处的实验现象为___________________。
(3)c处反应的化学方程式为_______________________ ______,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? (填“能”或“不能”),若能,其氧化性由强到弱的顺序是 。(若不能,此空不填)
(1)2MnO4– + 16H+ + 10Cl– = 2Mn2+ +5Cl2↑+ 8H2O 1:5 (每空2分)
(2)溶液由无色变为蓝色 溶液变为血红色 (每空1分)
(3)Cl2 + 2NaOH =" NaCl" + NaClO + H2O 0.01 (每空2分)
(4)能 (1分) KMnO4>Cl2>FeCl3 (2分)
解析试题分析:(1) e处发生反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,改写成离子方程式则为:2MnO4– + 16H+ + 10Cl– = 2Mn2+ +5Cl2↑+ 8H2O,从方程可知,KMnO4为氧化剂,其物质的量为2mol,HCl为还原剂,其物质的量为10mol,故两者物质的量之比为1:5。
(2)b处发生的反应为:Cl2 + 2KI =" 2KCl" + I2,生成的I2遇淀粉变蓝色;d处反应为:Cl2 + 2Fe2+ = 2Fe3+ + 2Cl–,Fe3+ + 3SCN– = Fe(SCN)3,所以溶液显血红色。
(3)c处Cl2与NaOH溶液反应:Cl2 + 2NaOH =" NaCl" + NaClO + H2O,标准状况下,0.224L Cl2的物质的量为0.01mol,因每1mol Cl2反应,转移1mol电子,所以转移的电子的物质的量为0.01mol。
(4)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂为KMnO4,氧化产物为Cl2,反应Cl2 + 2FeCl2 = 2FeCl3中,氧化剂为Cl2,氧化产物为FeCl3,根据“氧化剂的氧化性比氧化产物强”的规律可推知氧化性强弱顺序为:KMnO4>Cl2>FeCl3。
考点:考查氯气的制备和性质、氧化还原反应的相关内容。

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案(1)硫元素有多种化合价,可形成多种化合物。填写下表中的空白:
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | | FeS2 | S | Na2S2O3 | | SO3或H2SO4或Na2SO4 | Na2S2O8 |
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子: 。
Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。(不考虑水的蒸发)原因是
。
(4)某同学设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有 性。请你预测Na2S2O3还可能具有的化学性质(列举2条即可) 、 。
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性,实验室不能用浓硫酸干燥氨气,说明硫酸具有 性。
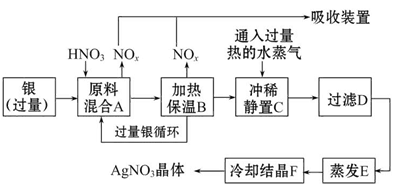
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是 (填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为 。
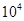 L(标准状况)该尾气需42.5gNH3,则x= _ 。
L(标准状况)该尾气需42.5gNH3,则x= _ 。
