题目内容
近年来,许多专家对石灰氮重新进行了深入研究,这也使得石灰氮这一古老的肥料又焕发了新的活力。石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、氮的质量分数分别为50%、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平)。请回答下列问题:
(1)石灰氮的化学式为 。
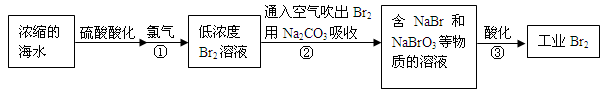
(2)足量B和C与饱和氯化钠溶液的反应是化工生产中生产某种重要化工产品的重要反应,试写出其化学方程式 。
(3)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I— 被氧化为I2时,含氮产物为 (填化学式)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质中不适合使用是 (填序号)。
a、磷酸 b、二氧化碳 c、稀硫酸 d、二氧化硫 e、次氯酸
(4)工业废水中的NO2— 可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质。写出上述反应的离子方程式: 。
(1)CaCN2
(2)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(3)NO ; b d e
(4)2Al+NO2-+OH-+H2O=2AlO2-+NH3↑
解析试题分析:(1)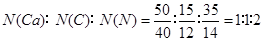 ,因此,化学式为:CaCN2
,因此,化学式为:CaCN2
(2)依题意可知:A为CaCO3,B为NH3,C为CO2,D为CaO,E为H2O,F为NO,G为NO2,所以足量B和C与饱和氯化钠溶液的反应: CNaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(3)在反应中得失电子是相等的,1摩尔的碘离子失去1摩尔的电子变成0.5摩尔的碘分子,同时,亚硝酸钠中的氮原子也应得到1摩尔的电子由正三价变成正二价的化合物:NO ;制备亚硝酸用的原理是强酸置换弱酸,但是碳酸跟次氯酸的酸性比醋酸的弱,那一定也比亚硝酸的弱,因为亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,但也不能选用二氧化硫,原因是,亚硝酸有氧化性,可以将二氧化硫氧化,而同时也被亚硝酸氧化。因此选: b d e
(4)首先得判断氧化剂和还原剂,还有氧化产物跟还原产物:2Al+NO2-+OH-+H2O=2AlO2-+NH3↑
考点:氧化还原反应的有关知识。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案三大强酸的性质均与浓度有关。回答下列问题:
(1)某学习小组用15 mol/L浓硝酸配制100 mL3 mol/L稀硝酸。
①他们需要用量筒量取15 mol/L浓硝酸_______mL;
②如下图所示仪器,在配制过程中不需用的是_________(填序号)。
除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器是___________;
③下列实验操作中,不正确的是_________(填写标号)。
| A.使用容量瓶前,检查它是否漏水。 |
| B.定容时液面超过刻度线,多出的液体应用胶头滴管吸出。 |
| C.配制溶液时,用量筒量取浓硝酸直接倒入容量瓶中,然后加蒸馏水定容。 |
| D.定容后盖好瓶塞,把容量瓶反复上下颠倒,摇匀。 |
(2)①铜与浓硫酸在加热条件下反应,浓硫酸表现出来的性质是___________。
②MnO2与浓盐酸在加热条件下反应,离子方程式为__________。
③分别用浓硝酸和稀硝酸制取相同质量Cu(NO3)2晶体,消耗浓硝酸和稀硝酸的物质的量之比是__________。






 Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0