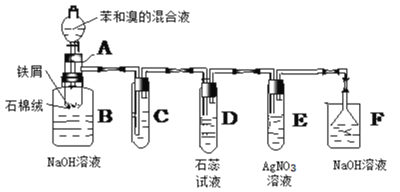
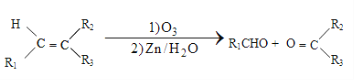��Ŀ����
����Ŀ��������̼�IJ����������������ʵ������������ŵ���Ҫ;��֮һ��
(1)������̼�ĵ���ʽΪ___________��
(2)�������ö�����̼�ķ�Ӧ��ԭ�������ʴ�100%����_____(�����)��
a��CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b��CO2��CH4![]() CH3COOH
CH3COOH
c��CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d��
(3)һ�����ڿ��������ö�����̼��ȡ�״����������£�

�ٷ�Ӧ(��)��CO2��H2Oת��Ϊ���᳣��;�������֣�����ͼ(a)�� (b)��

ͼ(a)��������Ҫת����ʽΪ____��ͼ(b)�з�����Ӧ�Ļ�ѧ����ʽΪ_____��
����5L�ĺ��º����ܱ������г���1moLCO��4molH2���������������Ӧ�����CO��CH3OH�����ʵ�����ʱ��仯����ͼ��ʾ��

ͼ�е�______min(������)��Ӧ�ﵽƽ�⣬CO��0��4min�ڵ�ƽ����Ӧ���ʱ���4��8min�ڵĿ죬��ԭ����______���ﵽƽ��ʱ������Ũ��Ϊ______��
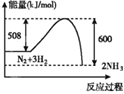
(4)��֪����(������)1mol��ѧ������(��ų�)��������Ϊ���ܣ���ӦH2(g)+ I2(g)=2HI(g)��ؼ����������£�
��ѧ�� | H��I | H��H | I��I |
����/kJ��mol��1 | 298.7 | 436.0 | 152.7 |
��÷�Ӧ�ġ�HΪ_________kJ��mol-1��
(5)��������Ϊ���������ں��º����ܱ������г���һ������NO��NH3����һ�������·�����Ӧ��6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)��
5N2(g) +6H2O(g)��
����˵���÷�Ӧ�Ѵﵽƽ��״̬�ı�־��_________(������ѡ��)��
a����Ӧ����v( NH3) =v( N2)
b��������ѹǿ������ʱ��������仯
c��������N2�����ʵ�������������ʱ��������仯
d��������n(NO)��n(NH3)��n(N2)��n(H2O) = 6��4��5��6
��ij��ʵ���в��������NO��N2�����ʵ�����ʱ��仯����ͼ��ʾ��ͼ��v(��)��v(��)��ȵĵ�Ϊ______(ѡ����ĸ)��
���𰸡�![]() bd ����ת���ɻ�ѧ�� 2CO2+2H2O
bd ����ת���ɻ�ѧ�� 2CO2+2H2O![]() 2HCOOH+ O2 10 0��4 min��Ӧ��Ũ�ȴ� 0.5mol��L-1 -8.7 bc cd
2HCOOH+ O2 10 0��4 min��Ӧ��Ũ�ȴ� 0.5mol��L-1 -8.7 bc cd
��������
(1)̼����֮���γ�˫������ԭ�Ӻ�̼ԭ������㶼Ϊ8�����ӣ�������̼�ĵ���ʽΪ![]() �� �ʴ�Ϊ��
�� �ʴ�Ϊ��![]() ��
��
(2)a���и���Ʒˮ���ɣ�ԭ��������û�дﵽ100%����a����
b����ӦΪ���Ϸ�Ӧ����Ӧ��ȫ��ת��Ϊ�����û�������������ɣ���ԭ�������ʴ�100%����b��ȷ��
c���и�����ˮ���ɣ�ԭ��������û�дﵽ100%����C����
d���÷�ӦΪ�ۺϷ�Ӧ��ԭ�������ʴﵽ100%����d��ȷ��
���ö�����̼�ķ�Ӧ��b�ǻ��Ϸ�Ӧ��d�ǾۺϷ�Ӧԭ�������ʴ�100%���ʴ�Ϊ��bd��
(3)ͼ(a)���ڹ��������½�CO2��H2Oת��Ϊ���ᣬ������Ҫת����ʽΪ����ת���ɻ�ѧ�ܣ�ͼ(b)��CO2��H2O����HCOOH�� O2��������Ӧ��ͨ�������������������������ɼ��ᣬ������Ӧ�Ļ�ѧ����ʽΪ2CO2+2H2O![]() 2HCOOH+ O2���ʴ�Ϊ������ת���ɻ�ѧ�ܣ�2CO2+2H2O
2HCOOH+ O2���ʴ�Ϊ������ת���ɻ�ѧ�ܣ�2CO2+2H2O![]() 2HCOOH+ O2��
2HCOOH+ O2��
�ڷ�Ӧ�ﵽƽ��״̬���ʵ����ʵ������䣬ͼ����10minʱ��Ӧ�ﵽƽ��״̬����ʱCO���ʵ���0.25mol���仯��1.00mol-0.25mol=0.75mol���״�������0.75mol��CO��0��4min�ڵ�ƽ����Ӧ���ʱ���4��8min�ڵĿ죬��ԭ�������ŷ�Ӧ�Ľ���CO��Ũ�Ȳ��ϱ�С���������������ѹǿ���ϼ�С����
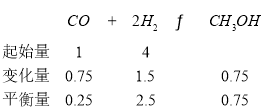
�ﵽƽ��ʱ������Ũ��=![]() =0.5mol��L��1��ƽ��ʱ������Ũ��Ϊ0.5mol��L-1���ʴ�Ϊ��10��0��4 min��Ӧ��Ũ�ȴ�0.5mol��L-1��
=0.5mol��L��1��ƽ��ʱ������Ũ��Ϊ0.5mol��L-1���ʴ�Ϊ��10��0��4 min��Ӧ��Ũ�ȴ�0.5mol��L-1��
(4)��ӦH2(g)+ I2(g)=2HI(g)�ġ�H=436.0kJ��mol-1+152.7kJ��mol-1-298.7kJ��mol-1��2=-8.7kJ��mol-1���ʴ�Ϊ��-8.7��
(5)��a���÷�Ӧ�ﵽƽ��״̬ʱ��5v��NH3����=4v��N2��������a����
b���÷�Ӧ��һ����Ӧǰ�������������Ŀ��淴Ӧ������Ӧ�ﵽƽ��״̬ʱ��������ѹǿ����ʱ��ı仯���仯���������жϷ�Ӧ�Ƿ�ﵽƽ��״̬����b��ȷ��
c��������N2�����ʵ�������������ʱ��������仯˵��Ũ�Ȳ��ڸı䣬��c��ȷ��
d�����ʵ���֮�Ȳ���˵�����淴Ӧ������Ȼ���Ũ�Ȳ��䣬��d����
�ʴ�Ϊ��bc��
��ͼ��a��b���Ӧ�����ʹ�ϵ�Ƿ�Ӧ������У�����ͼ��a��b���Ӧ�����ʹ�ϵ��v��������v���棩����c��d��ﵽƽ��ʱ���������������棩��ȣ�cd�����ʵ������ٸı䣬�ʴ�Ϊ��cd��

 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�