题目内容
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
(1)写出一种可以提高NO的转化率的方法:__________
(2)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO) =2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是___________
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H键断裂的同时,生成1molO—H键
(3)已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=_____,y=_______。
(4)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:

①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=_______;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________。
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如图。

(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。写出该反应的化学方程式____。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是________________。
【答案】降低温度(或“增大压强”、“分离出氮气”、“增大氨气浓度”等) AE 5 0 0.171 molL-1·min-1 平衡逆向移动 (NH2)2CO+NO+NO2 =2N2+CO2+2H2O NO在尿素溶液中的溶解度较低,未参与反应的NO增多
【解析】
(1)不增加一氧化氮的量使平衡右移可提高一氧化氮转化率;
(2)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(3)根据K=![]() 进行推导;
进行推导;
(4)①根据![]() 计算反应速率;
计算反应速率;
②平衡逆向移动一氧化氮的转化率降低;
(5)NO和NO2的体积比为一比一,即反应中化学计量数之比为一比一,将N元素转变为对环境无害的气体即氮气,根据元素守恒和电子守恒配平方程式;
(6)一氧化氮不溶于水,大量的一氧化氮不能反应。
(1)该反应焓变小于零,为放热反应,降温可以使平衡右移,增大一氧化氮转化率;该反应为压强减小的反应,故增大压强可使平衡右移;加入氨气或者移走生成物氮气都可以使平衡右移增大一氧化氮转化率,故答案为:降低温度(或“增大压强”、“分离出氮气”、“增大氨气浓度”等);
(2)A.根据方程式可知氨气与一氧化氮按2:3反应,且按n(NH3)︰n(NO) =2︰3充入反应物,所以,任意时刻都满足c(NH3)︰c(NO) =2︰3,故A错误;
B.反应正向移动时氨气的物质的量减小,氮气的物质的量增多,所以n(NH3)︰n(N2)会变小,当该值不在变化时说明反应达到平衡,故B正确;
C.平衡正向移动压强减小,逆向移动压强增大,所以压强不变时反应达到平衡,故C正确;
D.生成物中有液态水,所以平衡正向移动时气体的总质量减小,但总体积不变,所以密度会减小,所以当混合气体密度不变时能说明反应平衡,故D正确;
E.1molN—H键断裂即消耗![]() mol氨气,则生成
mol氨气,则生成![]() mol水,形成1molO—H键,描述的都是正反应速率,故E错误;
mol水,形成1molO—H键,描述的都是正反应速率,故E错误;
故答案为AE;
(3)当反应达到平衡时有v正= v逆,即k正·c4(NH3)·c6 (NO) =k逆·cx(N2)·cy(H2O),变换可得![]() ,该反应的平衡常数K=k正/k逆,平衡状态下K=
,该反应的平衡常数K=k正/k逆,平衡状态下K=![]() ,所以x=5,y=0,故答案为:5;0;
,所以x=5,y=0,故答案为:5;0;
(4)①420K时一氧化氮的转化率为2%,此时消耗的n(NO)=3mol×2%=0.06mol,580K时一氧化氮的转化率为59%,此时消耗的n(NO)=3mol×59%=1.77mol,此时段内一氧化氮的变化量为:1.77mol-0.06mol=1.71mol,容器的体积为2L,所以反应速率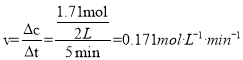 ,故答案为:0.171 molL-1·min-1;
,故答案为:0.171 molL-1·min-1;
②该反应为放热反应,温度升高,平衡逆向移动,一氧化氮的转化率降低;故答案为:平衡逆向移动;
(5)NO和NO2的体积比为一比一,即反应中化学计量数之比为一比一,将N元素转变为对环境无害的气体即氮气,根据元素守恒和电子守恒可知方程式为:(NH2)2CO+NO+NO2 =2N2+CO2+2H2O,故答案为(NH2)2CO+NO+NO2 =2N2+CO2+2H2O;
(6)一氧化氮溶解度小,大量的一氧化氮通入之后不能反应,导致总还原率降低,故答案为:NO在尿素溶液中的溶解度较低,未参与反应的NO增多。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】二氧化碳的捕捉、封存与再利用是实现温室气体减排的重要途径之一。
(1)二氧化碳的电子式为___________。
(2)下列利用二氧化碳的反应中原子利用率达100%的是_____(填序号)。
a.CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b.CO2+CH4![]() CH3COOH
CH3COOH
c.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d.
(3)一种正在开发的利用二氧化碳制取甲醇的流程如下:

①反应(Ⅰ)将CO2和H2O转化为甲酸常用途径有两种,如下图(a)和 (b)。

图(a)中能量主要转化方式为____,图(b)中发生反应的化学方程式为_____。
②在5L的恒温恒容密闭容器中充入1moLCO和4molH2,加入催化剂发生反应,测得CO及CH3OH的物质的量随时间变化如下图所示。

图中第______min(填数字)反应达到平衡,CO在0~4min内的平均反应速率比在4~8min内的快,其原因是______;达到平衡时氢气的浓度为______。
(4)已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能,反应H2(g)+ I2(g)=2HI(g)相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的△H为_________kJ·mol-1。
(5)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_________(不定项选择)。
a.反应速率v( NH3) =v( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如下图所示,图中v(正)与v(逆)相等的点为______(选填字母)。