题目内容
【题目】某探究小组在某温度下测定溶液的pH时发现0.01mol/L 的NaOH溶液中,由水电离出的c(H+)c(OH-)=10-22,该探究小组将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:10混合,混合后所得溶液恰好呈中性,若x=![]() y,则x为( )
y,则x为( )
A.2B.3C.4D.5
【答案】B
【解析】
某温度下0.01molL-1的NaOH溶液中,由水电离出的c(H+)c(OH-)=10-22,水电离的c(H+)=c(OH-)=10-11mol/L,碱溶液中H+全部来自水电离,则Kw=c(H+)c(OH-)=10-11mol/L×0.01mol/L=10-13(molL-1)2;将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:10混合,混合后所得溶液恰好呈中性,即n(H+)=n(OH-),此时10-x×1=10y-13×10,解得x+y=12,若x=![]() y,则x=3,故选B。
y,则x=3,故选B。

【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
【题目】下列粒子![]() 分子或离子
分子或离子![]() 均含有18个电子:
均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是![]()
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键
【题目】历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置_________,Ag+的价电子排布式为_________。
(2)冶金工业上,提取金的原理是2[Au(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
(3)已知基态铜的部分电离能如表所示:
电离能/kJ/mol | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是_________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到结构如图所示配合物。
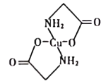
①配合物中碳原子的轨道杂化类型为_________。
②1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为_________个;该晶体的化学式为_________。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和Q原子之问的最短距离为_________pm(1pm=10-12m,只写计算式)。