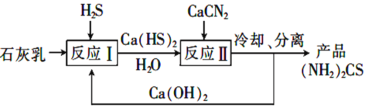
题目内容
【题目】吊白块(NaHSO2HCHO2H2O,次硫酸氢钠甲醛)是易溶于水的白色块状或结晶性粉状固体,在印染工业中被用作拔染剂和还原剂。可由Na2S2O5 (焦亚硫酸钠)、甲醛及锌粉反应制取,回答下列问题:
(1)已知在pH=4.1时的过饱和NaHSO3溶液将自动脱水生成Na2S2O5,制备原料Na2S2O5的装置如下。
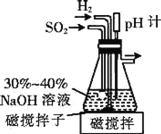
①通入H2的目的是______。
②吸滤瓶中先后发生的反应为_______、2NaHSO3=Na2S2O5↓+H2O。
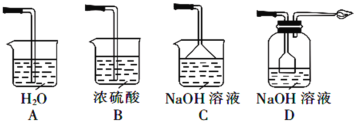
③从环境保护和安全考虑,下列尾气处理方法正确的是________(填标号)。
④实验室用稀NaOH溶液不能制得Na2S2O5,是因为_______。
(2)制备吊白块的装置(夹持及加热装置已略)如图:
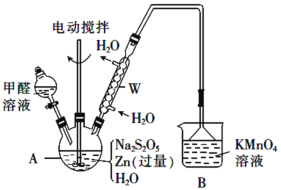
①仪器A的名称是_________。
②制备反应需在950C下进行,合适的加热方式是_____,A中发生反应的化学方程式为_____(Zn转化为等物质的量的ZnO和Zn(OH)2)。
③从A中的悬浊液中得到产品吊白块的实验操作是_________及干燥。
【答案】排除装置内空气,防止焦亚硫酸钠被氧化 2NaOH+SO2=Na2SO3+H2O,SO2+Na2SO3+H2O=2NaHSO3 D 不能得到NaHSO3过饱和溶液 三颈烧瓶 热水浴 Na2S2O5+2Zn+2HCHO+6H2O![]() 2NaHSO2HCHO2H2O+ZnO+Zn(OH)2或Na2S2O5+2Zn+2HCHO+4H2O
2NaHSO2HCHO2H2O+ZnO+Zn(OH)2或Na2S2O5+2Zn+2HCHO+4H2O![]() 2NaHSO2HCHO+ZnO+Zn(OH)2 过滤、蒸发浓缩、冷却结晶、过滤、洗涤
2NaHSO2HCHO+ZnO+Zn(OH)2 过滤、蒸发浓缩、冷却结晶、过滤、洗涤
【解析】
(1)二氧化硫和NaOH反应生成亚硫酸钠,亚硫酸钠和水和二氧化硫反应生成亚硫酸氢钠,调控pH=4.1,使亚硫酸氢钠过饱和溶液自动脱水生成Na2S2O5;
(2)用热水浴控制温度在95℃加热甲醛、Na2S2O5、Zn粉、H2O混合物得含次硫酸氢钠甲醛、ZnO和Zn(OH)2的混合物,次硫酸氢钠甲醛易溶于水,Zn和Zn(OH)2不溶于水,故通过过滤除去Zn和Zn(OH)2,将滤液蒸发浓缩、冷却结晶、过滤、洗涤得吊白块(NaHSO2HCHO2H2O),据此解答。
(1)①Na2S2O5中的S元素化合价均为+4,具有还原性,为避免装置内空气中的氧气将这些物质氧化,需通入一定时间的氢气排除空气,故答案为:排除装置内空气,防止焦亚硫酸钠被氧化;
②二氧化硫和NaOH溶液反应生成亚硫酸钠和水,亚硫酸钠和水和二氧化硫反应生成亚硫酸氢钠,亚硫酸氢钠过饱和溶液脱水得焦亚硫酸钠,所以抽滤瓶中发生的反应为:2NaOH+SO2=Na2SO3+H2O,SO2+Na2SO3+H2O=2NaHSO3,2NaHSO3=Na2S2O5↓+H2O,故答案为:2NaOH+SO2=Na2SO3+H2O,SO2+Na2SO3+H2O=2NaHSO3;
③随着吸滤瓶中得到饱和亚硫酸氢钠,二氧化硫的溶解度减小,尾气中将含二氧化硫污染空气,同时也含氢气,所以需要尾气处理装置:
A.水不能吸收氢气,同时二氧化硫易溶于水,可能引起倒吸,A不满足题意;
B.氢气和二氧化硫均不能被吸收,B不满足题意;
C.氢气不能被吸收,C不满足题意;
D.二氧化硫被NaOH溶液吸收,装置具有防倒吸作用,氢气用点燃法处理,D满足题意;
故答案为:D;
④NaOH溶液浓度太小不能得到NaHSO3过饱和溶液,故答案为:不能得到NaHSO3过饱和溶液;
(2)①仪器A为三颈烧瓶,故答案为:三颈烧瓶;
②0-100℃可用水浴控制,95℃用热水浴加热,甲醛、Na2S2O5、Zn粉、H2O在A中发生反应生成硫酸氢钠甲醛、等物质的量的ZnO、Zn(OH)2,结合得失电子守恒、原子守恒可得该反应化学方程式为:Na2S2O5+2Zn+2HCHO+6H2O![]() 2NaHSO2HCHO2H2O+ZnO+Zn(OH)2或Na2S2O5+2Zn+2HCHO+4H2O
2NaHSO2HCHO2H2O+ZnO+Zn(OH)2或Na2S2O5+2Zn+2HCHO+4H2O![]() 2NaHSO2HCHO+ZnO+Zn(OH)2,故答案为:热水浴;Na2S2O5+2Zn+2HCHO+6H2O
2NaHSO2HCHO+ZnO+Zn(OH)2,故答案为:热水浴;Na2S2O5+2Zn+2HCHO+6H2O![]() 2NaHSO2HCHO2H2O+ZnO+Zn(OH)2或Na2S2O5+2Zn+2HCHO+4H2O
2NaHSO2HCHO2H2O+ZnO+Zn(OH)2或Na2S2O5+2Zn+2HCHO+4H2O![]() 2NaHSO2HCHO+ZnO+Zn(OH)2;
2NaHSO2HCHO+ZnO+Zn(OH)2;
③硫酸氢钠甲醛易溶于水,Zn和Zn(OH)2不溶于水,故通过过滤除去Zn和Zn(OH)2,将滤液蒸发浓缩、冷却结晶、过滤、洗涤得吊白块(NaHSO2HCHO2H2O),故答案为:过滤、蒸发浓缩、冷却结晶、过滤、洗涤。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】碱式碳酸铋片[主要成分(BiO)2CO3]可用于治疗慢性胃炎及缓解胃酸过多引起的胃病。由菱铋矿(主要成分为nBi2O3·mCO2·H2O,含杂质SiO2、CuS等)制备(BiO)2CO3的一种工艺如图:
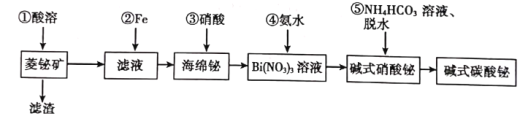
试回答下列问题:
(1)为提高①的“酸溶”速率,可以采取的措施是__________(任写一种)。
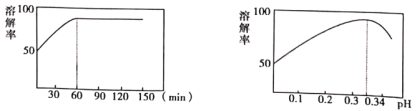
(2)①中酸溶解率与接触时间及溶液的pH之间的关系如图,据此分析,“酸溶”的最佳条件为__________;滤渣的主要成分是__________。
(3)“酸溶”后溶液必须保持强酸性,以防止铋元素流失,原理是__________。
(4)②中得到“海绵铋”的离子方程式为__________。
(5)④中反应的化学反应方程式为__________。
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Cu2+、Bi3+的混合溶液中滴加Na2S溶液,当Fe2+恰好沉淀完全时,所得溶液c(Cu2+):c(Bi3+)=__________。(忽略Na2S溶液所带来的体积变化)。
资料:①有关溶度积数据见表:
难溶物质 | FeS | CuS | Bi2S3 |
Ksp(25℃) | 6.3×10-18 | 6.3×10-36 | 1.6×10-20 |
②溶液中的离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。