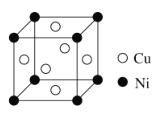
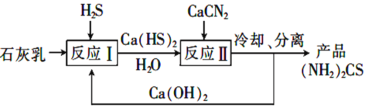
题目内容
【题目】在常温条件下,下列对醋酸的叙述中,不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小
C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14
【答案】D
【解析】
A.pH=5.6的CH3COOH与CH3COONa混合溶液中,电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),pH=5.6,则c(H+>(OH-),所以c(Na+)<c(CH3COO-),A正确;
B.加水稀释促进电离,则氢离子的物质的量增大,醋酸的物质的量减小,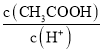 =
= 变小,B正确;
变小,B正确;
C.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],C正确;
D.pH=a的醋酸与pH=b的NaOH溶液恰好中和,醋酸和氢氧化钠的物质的量相等,醋酸为弱酸,醋酸部分电离,醋酸的浓度大于氢离子的浓度,即c(CH3COOH)>10-amol/L,氢氧化钠的浓度等氢氧根离子的浓度,即c(NaOH)=10b-14mol/L,c(CH3COOH)=c(NaOH)=10b-14mol/L>10-amol,则a+b>14,D错误;
故选D。

【题目】请根据所给图形回答下列问题:
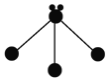
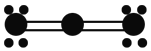
⑴图表示容器中气体粒子的示意图,图中“![]() ”和“
”和“![]() ”分别代表不同元素的原子,它们的结合体代表分子,则图中可表示氮气的是______,可表示氯化氢(HCl)分子的是______,可表示一氧化碳和氧气的混合气体的是______(填序号)。
”分别代表不同元素的原子,它们的结合体代表分子,则图中可表示氮气的是______,可表示氯化氢(HCl)分子的是______,可表示一氧化碳和氧气的混合气体的是______(填序号)。
|
|
|
|
A | B | C | D |
⑵如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是______(填序号)。
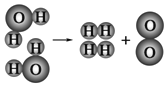
A 生成1mol O2需断开4mol H—O共价键
B 水分解后生成氢气和氧气的分子数比为2:1
C 水分解过程中,分子的种类不变
D 水分解过程中,原子的数目不变
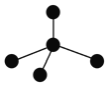
⑶表各图中的小球代表原子序数从1—18元素的原子实![]() 原子实是原子除最外层电子后剩余的部分
原子实是原子除最外层电子后剩余的部分![]() ,小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是______(填序号)。
,小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是______(填序号)。
A | B | C |
|
|
|
NH3 | CO2 | CCl4 |