题目内容
15.下列各组顺序的排列不正确的是( )| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 氧化性:K+<Na+<Mg2+<Al3+ |
分析 A、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B、电子数层相同的离子,核电荷数越多,离子半径越小;
C、元素的非金属性越强,对应的氢化物越稳定;
D、元素的金属性越强,对应的阳离子的氧化性越弱;
解答 解:A、元素地非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性Cl>S>P,所以酸性强弱:HClO4>H2SO4>H3PO4,故A正确;
B、电子层数相同的离子,核电荷数越多,离子半径越小,所以离子半径:F->Na+>Mg2+>Al3+,故B错误;
C、元素的非金属性越强,对应的氢化物越稳定,非金属性Cl>S>P>Si,所以热稳定性:HCl>H2S>PH3>SiH4,故C正确;
D、元素的金属性越强,对应的阳离子的氧化性越弱,金属性K>Na>Mg>Al,所以氧化性:K+<Na+<Mg2+<Al3+,故D正确,
故选B;
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
5.在反应 3NO2+H2O→2HNO3+NO 中NO2的作用是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
6.如图为铜-锌-稀硫酸构成的原电池示意图,下列说法正确的是( )
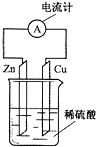

| A. | 锌片为正极,且锌片逐渐溶解 | B. | 铜片为负极,且铜片上有气泡 | ||
| C. | 溶液中的H+移向铜极 | D. | 该装置能将电能转变为化学能 |
10.某学生对SO2与漂粉精的反应进行实验探究:
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(2)pH试纸颜色的变化说明漂粉精溶液具有的化学性质是碱性;漂白性.
(3)用离子方程式解释现象ⅲ中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
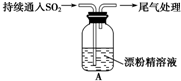 | ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的化学性质是碱性;漂白性.
(3)用离子方程式解释现象ⅲ中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温下,23 g NO2含有0.5NA个氮原子 | |
| B. | 1L 0.1 mol•L-1硫酸铵溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
7.下列表述正确的是( )
| A. | CO2的比例模型: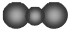 | |
| B. | 氢化铵(NH4H)电子式: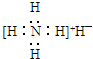 | |
| C. | (CH3)3COH的名称:2,2-二甲基乙醇 | |
| D. | 乙酸乙酯的水解CH3COOCH2CH3+H218O $?_{△}^{酸}$CH3CO18OH+CH3CH2OH |
4.将100mL溶液中含硫酸0.01mol、硝酸0.04mol,若在该溶液中投入1.92g铜粉微热,反应后放出一氧化氮气体标准状况下体积约为( )
| A. | 0.448L | B. | 0.336L | C. | 0.224L | D. | 无法计算 |
6.能用一种试剂鉴别乙醛、乙酸、甲酸、苯、四氯化碳的是( )
| A. | 银氨溶液 | B. | 新制Cu(OH)2 | C. | FeCl3 | D. | 溴水 |
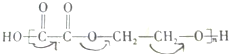 )是一种重要的化工原料,某种由A制备G的工艺流程如下,请回答:
)是一种重要的化工原料,某种由A制备G的工艺流程如下,请回答: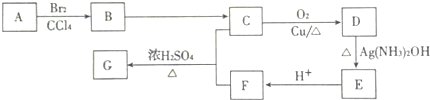
 +(2n-1)H2O.
+(2n-1)H2O.