题目内容
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 常温下,23 g NO2含有0.5NA个氮原子 | |
| B. | 1L 0.1 mol•L-1硫酸铵溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
分析 A.23g二氧化氮的物质的量为0.5mol,含有氮原子数为0.5mol×1×NA;
B.铵根离子发生水解;
C.常温常压下,四氯化碳不是气体;
D.1mol Fe2+与足量的H2O2溶液反应,转移NA个电子.
解答 解:A.23g二氧化氮的物质的量为0.5mol,含有氮原子数为0.5mol×1×NA,故A正确;
B.铵根离子发生水解,1L 0.1 mol•L-1硫酸铵溶液中NH4+小于0.2NA,故B错误;
C.常温常压下,四氯化碳不是气体,题中条件无法计算22.4L四氯化碳的物质的量,故C错误;
D.1mol Fe2+与足量的H2O2溶液反应,转移NA个电子,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件、标况下四氯化碳不是气体.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
10.能够证明SO2中含有CO2的方法是将气体( )
| A. | 通入澄清石灰水 | |
| B. | 先通入酸性KMnO4溶液,再通入石灰水 | |
| C. | 通入品红溶液 | |
| D. | 先通入饱和NaHCO3溶液,在通入石灰水 |
11.下列装置或操作不能达到实验目的是( )
| A. | 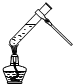 葡萄糖的银镜反应 | B. | 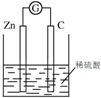 形成原电池 | ||
| C. | 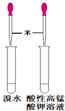 检验苯中有无碳碳双键 | D. | 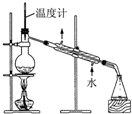 石油的分馏 |
8.为验证蔗糖能水解,且水解产物有还原性,可能有以下实验步骤:(1)加入稀硫酸;(2)加入几滴CuSO4溶液;(3)加热;(4)加入蒸馏水;(5)加入烧碱溶液至中性;(6)加入新制Cu(OH)2.最佳顺序是( )
| A. | (4)(1)(3)(6)(3) | B. | (4)(3)(1)(6)(5)(3) | C. | (1)(3)(2)(6)(3) | D. | (4)(1)(3)(5)(6)(3) |
15.下列各组顺序的排列不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 氧化性:K+<Na+<Mg2+<Al3+ |
12.一定温度下、物质的量浓度相同的四种溶液:①CH3COONa、②NaHSO4、③NaCl、④C6H5ONa,溶液中c(H+)的排顺正确的是( )
| A. | ④<①<③<② | B. | ①<④<③<② | C. | ①<②<③<④ | D. | ④<③<①<② |
9.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 125g CuSO4•5H2O晶体中含有Cu2+离子数一定小于0.5NA | |
| B. | 常温下,pH=3的醋酸溶液中,醋酸分子的数目一定大于10-3NA | |
| C. | 由S6、S7、S8组成的硫蒸气6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 3.6g C与3.36L O2一定条件下恰好完全反应,生成CO分子数一定为0.3NA |
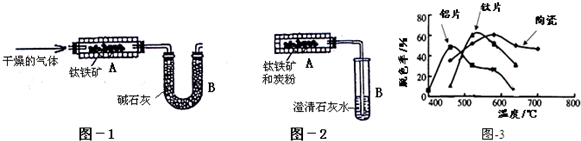
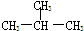
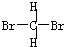 和
和 E.甲烷和庚烷F.
E.甲烷和庚烷F.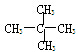 和C(CH)3
和C(CH)3