题目内容
【题目】如图所示与对应叙述相符的是
A.图 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则 Ksp(FeS)<Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则 Ksp(FeS)<Ksp(CuS)
B.图 表示等体积的pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
表示等体积的pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C.某温度下向20 mL 0.1 mol·L-1的CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,pH变化曲线如图所示 (忽略温度变化),则①点(CH3COO—)>c(Na+)>c(CH3COOH)
(忽略温度变化),则①点(CH3COO—)>c(Na+)>c(CH3COOH)
D.图 表示反应N2(g)+3H2(g)
表示反应N2(g)+3H2(g)![]() 2NH3(g)平衡时NH3体积分数随起始 n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始 n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
【答案】C
【解析】
A.根据FeS和CuS的溶度积表达式分析二者溶度积大小;
B.溶液酸性越强,稀释溶液时pH变化幅度越大;
C.①点NaOH不足,溶液成分为醋酸和醋酸钠,溶液呈酸性;
D.氮气的物质的量不同,对平衡移动的影响不同。
A.Ksp(FeS)=c(Fe2+)c(S2-),Ksp(CuS)=c(Cu2+)c(S2-),根据图象,c(S2-)相同时,c(Fe2+)>c(Cu2+),所以Ksp(FeS)>Ksp(CuS),故A错误;
B.溶液酸性越强,稀释溶液时pH变化幅度越大,根据图象,稀释溶液时,甲酸的pH变化幅度更大,所以甲酸的酸性更强,即酸性甲酸>乙酸,故B错误;
C.①点NaOH不足,溶液成分为等量的醋酸和醋酸钠,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,则c(CH3COO-)>c(Na+)>c(CH3COOH),故C正确;
D.氮气的浓度越大,越有利于平衡正向移动,氢气的转化率越大,则转化率:αA(H2)<αB(H2),故D错误,
故选:C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究CO、CO2的回收对减少碳的排放、改善生态环境和构建生态文明具有重要的意义。回答下列问题:
(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH=99 kJ·mol1
CH3OH(g) ΔH=99 kJ·mol1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ·mol1
CO(g)+H2O(g) ΔH=+41 kJ·mol1
则反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=_________。
CH3OH(g)+H2O(g) ΔH=_________。
(2)向容积相同的三个恒容密闭容器中分别通入一定量H2、CO,控制适当条件使其发生反应:2H2(g)+CO(g)![]() CH3OH(g),反应中有关数据如下表所示:
CH3OH(g),反应中有关数据如下表所示:
容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | |
c(H2) | c(CO) | c(CH3OH) | ||
A | 350 | 0.40 | 0.20 | 0.16 |
B | 350 | 0.80 | 0.40 | |
C | T | 0.40 | 0.20 | 0.05 |
反应从开始到达到平衡时,平均反应速率:容器A____容器C(填“>”或“<”,后同),容器B中CO的转化率____80%。
(3)①CO2和H2在一定条件下能发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
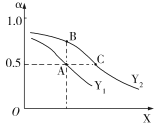
X表示___(填“温度”或“压强”),状态A、B、C对应的平衡常数K(A)、K(B)、K(C)的相对大小顺序为_____。
②向M、N两个初始容积相同的密闭容器中各充入2 mol CO2 和6 mol H2,控制适当条件使其发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
(4)用NaOH溶液做碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=10的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(
)=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。