题目内容
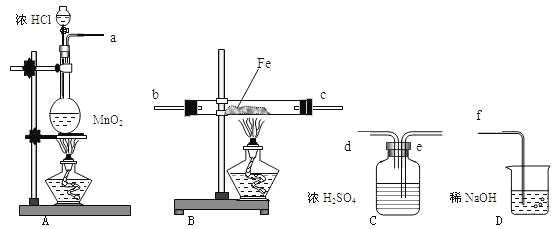
【题目】为了讲授“氯气的性质和用途”,一老师以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行教学。
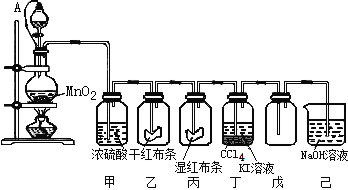
试回答下列问题:
(1)乙和丙中的现象分别是 ____________________、____________________;由上述现象可得出结论:_____________________(写化学式)具有漂白作用;
(2)分离丁中液体的方法是 _______;
(3)圆底烧瓶内发生反应的化学方程式为__________________________________;
(4)分液漏斗与烧瓶连接橡皮管的目的是 __________________________________;
(5)己烧杯中反应的离子方程式为:________________________________________;
(6)将产生的Cl2通入FeCl2溶液中得到含有FeCl2和FeCl3的混合物,实验测得混合物中n(Fe元素)∶n(Cl元素)=1:2.4,则该溶液中Fe2+和Fe3+的物质的量浓度之比约为______。
【答案】布条不褪色 布条褪色 HClO 分液 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 平衡气压,使盐酸顺利流下 Cl2 + 2OH- =Cl- + ClO- + H2O 3:2
MnCl2+Cl2↑+2H2O 平衡气压,使盐酸顺利流下 Cl2 + 2OH- =Cl- + ClO- + H2O 3:2
【解析】
制得的氯气经过浓硫酸干燥后得到干燥的氯气(可能混有少量氯化氢气体),结合氯气和氯水的性质分析解答(1)~(3)和(5);
(4)根据橡皮管可以使分液漏斗与烧瓶内气压相等分析解答;
(6)设二价铁离子物质的量为x,三价铁离子的物质的量为y,依据n(Fe元素)∶n(Cl元素)=1∶2.4计算解答。
(1)氯气不具有漂白性,次氯酸具有漂白性,通入到乙中的氯气为干燥氯气,所以不能使红色布条褪色,通入丙中的氯气与湿润布条中的水反应生成有漂白性的次氯酸,所以有色布条褪色,故答案为:红布条不褪色;红布条褪色;HClO;
(2)氯气与碘化钾反应生成碘单质,碘易溶于四氯化碳,四氯化碳不溶于水,密度大于水,分层,所以可以用分液的方法分离,故答案为:分液;
(3)二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4)利用针头的橡皮管连接后,分液漏斗与烧瓶内气压相等,有利于液体流下,故答案为:平衡气压,使盐酸顺利流下;
(5)己烧杯中氢氧化钠与氯气反应的离子方程式为Cl2 + 2OH- =Cl-+ ClO- + H2O,故答案为:Cl2 + 2OH- =Cl-+ ClO- + H2O;
(6)设二价铁离子物质的量为x,三价铁离子的物质的量为y,则氯离子的物质的量为2x+3y,依据n(Fe元素)∶n(Cl元素)=1∶2.4可知:(x+y)∶(2x+3y)=1∶2.4,解得x∶y=3∶2,故答案为:3∶2。

【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2