题目内容
【题目】三草酸合铁酸钾[K3Fe(C2O4)33H2O]是制备负载型活性铁催化剂的主要原料。某化学小组探究用废铁屑(含少量-2价S元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体。具体流程如图:
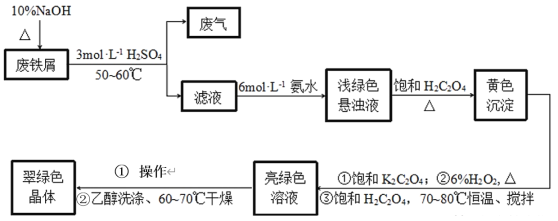
已知:①(NH4)2Fe(SO4)26H2O为蓝绿色晶体,FeC2O4·2H2O为难溶于水的黄色晶体,K3Fe(C2O4)3·3H2O为可溶于水、难溶于乙醇的翠绿色晶体。
②25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O![]() (aq) K=6.31×10-17。
(aq) K=6.31×10-17。
③[Fe(SCN)]2+(aq)为血红色。
回答下列问题:
(1)三草酸合铁酸钾[K3Fe(C2O4)33H2O]中铁的化合价是_____。
(2)废铁屑中加入10%NaOH并加热的目的是__。
(3)为防止污染空气,反应所产生的“废气”可选择__净化处理。(填选项)
A.H2O B.NaOH溶液 C.盐酸 D.CuSO4溶液
(4)写出浅绿色悬浊液中加入饱和H2C2O4生成黄色沉淀的化学方程式:__。
(5)制备过程中加入6%H2O2的目的是__,温度保持70~80℃,采用的合适加热方式是__。
(6)获得翠绿晶体的操作①是___。
(7)用乙醇洗涤晶体的原因是___。
(8)某同学欲检验所制晶体中的Fe(Ⅲ),取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1molL-1KSCN溶液。请判断上述实验方案是否可行并说明理由:___。
【答案】+3 去除废铁屑表面的油污 BD (NH4)2Fe(SO4)26H2O+H2C2O4=FeC2O42H2O+(NH4)2SO4+H2SO4+4H2O 将Fe(Ⅱ)氧化成Fe(Ⅲ) 水浴加热 加热浓缩,冷却结晶,过滤 为了除去晶体表面残留的水分且防止晶体溶解损失 否,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验
【解析】
废铁屑先用热的NaOH溶液除去表面的油污,然后加入稀硫酸,铁和稀硫酸反应生成硫酸亚铁,-2价S元素遇酸转变为有毒气体H2S,H2S可以用NaOH溶液或CuSO4溶液吸收。得到的硫酸亚铁溶液中加入氨水,生成(NH4)2Fe(SO4)26H2O,再加入饱和H2C2O4,生成难溶于水的黄色晶体FeC2O4·2H2O,过滤后向沉淀中加入饱和K2C2O4,然后加入6%H2O2溶液,使Fe(Ⅱ)被氧化成Fe(Ⅲ),再加入饱和H2C2O4,得到K3Fe(C2O4)3溶液,溶液经蒸发浓缩、冷却结晶,过滤得到K3Fe(C2O4)3·3H2O晶体,用乙醇洗涤,干燥后得到纯净的K3Fe(C2O4)3·3H2O。
(1)三草酸合铁酸钾[K3Fe(C2O4)33H2O]中钾为+1价,碳为+3价,氧为-2价,根据正负化合价代数和为0的原则,可计算出铁的化合价是+3价。
(2)废铁屑长期露置于空气中,表面会有油污,加热时油污可以在碱性环境下彻底水解,所以加入10%NaOH并加热的目的是去除废铁屑表面的油污。
(3)废铁屑中-2价S元素遇酸转变为有毒气体H2S,H2S是酸性气体,能溶于碱溶液,可以用NaOH溶液吸收,H2S也可以和硫酸铜溶液反应生成CuS沉淀,所以也可以用CuSO4溶液吸收,故选BD。
(4)浅绿色悬浊液中有(NH4)2Fe(SO4)26H2O,加入饱和H2C2O4生成黄色沉淀FeC2O4·2H2O,化学方程式为:(NH4)2Fe(SO4)26H2O+H2C2O4=FeC2O42H2O+(NH4)2SO4+H2SO4+4H2O。
(5)黄色沉淀是FeC2O4·2H2O,其中铁是+2价,要制备的K3Fe(C2O4)33H2O中铁是+3价,所以需要将Fe(Ⅱ)氧化成Fe(Ⅲ),所以加入6%H2O2的目的是将Fe(Ⅱ)氧化成Fe(Ⅲ),温度保持70~80℃,采用的合适加热方式是水浴加热。
(6)从K3Fe(C2O4)3溶液中获得K3Fe(C2O4)3·3H2O晶体,需经蒸发浓缩、冷却结晶,过滤。
(7)由于K3Fe(C2O4)3·3H2O难溶于乙醇,所以用乙醇洗涤,既可以除去晶体表面残留的水分,又能防止晶体溶解损失。
(8)根据[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O42- (aq) K=6.31×10-17,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验所制晶体中是否含Fe(Ⅲ)。
[Fe(SCN)]2+(aq)+3C2O42- (aq) K=6.31×10-17,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验所制晶体中是否含Fe(Ⅲ)。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】不能用勒夏特列原理解释的是
A.使用铁触媒,加快合成氨反应速率
B.过量空气有利于SO2转化为SO3
C.打开汽水瓶盖,即有大量气泡逸出
D.将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量__;充入氦气,混合气体的密度__(填“增大”“减小”或“不变”)。
(2)830℃,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
①写出CH3COOH的电离方程式____,其电离平衡常数表达式K a=___;
②根据表中数据判断,浓度均为0.01mol·L-1的下列三种物质的溶液中,酸性最强的是___(填编号);将下列各溶液分别稀释100倍,pH变化最小的是___(填编号)。
A.CH3COOH B.H2CO3 C.H2SO3