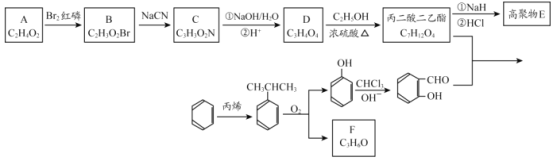
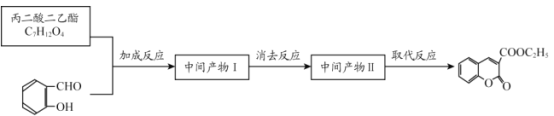
题目内容
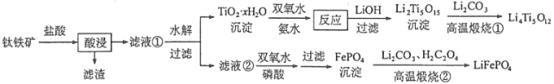
【题目】今年6月比亚迪正式发布刀片电池,大幅度提高了电动汽车的续航里程可媲美特斯拉,刀片电池采用磷酸铁锂技术。可利用钛铁矿[主要成分为FeTiO3(难溶性亚铁盐),还含有少量MgO等杂质]来制备LiFePO4和Li4Ti5O12等锂离子电池的电极材料,工艺流程如图:
回答下列问题:
(1)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式 _______。
(2)TiO2xH2O沉淀与双氧水、氨水“反应”转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示:
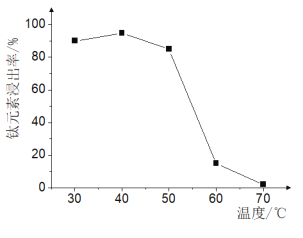
反应温度过高时,Ti元素浸出率变化的原因是 ________。
(3)“滤液②”中含有的金属离子是 _______;加入双氧水和磷酸使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时溶液中 c(PO43-)=________。(FePO4的 Ksp=1.3×10 -22)
(4)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
(5)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为_____。
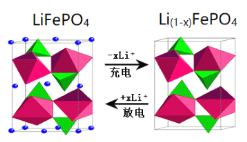
(6)作为刀片电池正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,则正极电极反应式是_________。
【答案】FeTiO3+4H++4Cl-= Fe2++TiOCl42-+2H2O 温度过高时,由于双氧水分解与氨气逸出,Ti元素浸出率下降 Fe2+、Mg2+ 1.3×10 –17 molL 1 2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑ 4 Li(1﹣x)FePO4+xLi++xe-=LiFePO4
2LiFePO4+H2O↑+3CO2↑ 4 Li(1﹣x)FePO4+xLi++xe-=LiFePO4
【解析】
用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备Li4Ti5O12和LiFePO4,由制备流程可知,加盐酸过滤后的滤渣为SiO2,滤液①中含Mg2+、Fe2+、Ti4+,水解后过滤,沉淀为TiO2·xH2O,与双氧水反应Ti元素的化合价升高,生成(NH4)2Ti5O15,与LiOH反应后过滤得到Li2Ti5O15,再与碳酸锂高温反应生成Li4Ti5O12;水解后的滤液②中含Mg2+、Fe2+,双氧水可氧化Fe2+为Fe3+,在磷酸条件下反应产生FePO4沉淀,过滤分离出FePO4,高温煅烧②中发生2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑,以此来解答。
2LiFePO4+H2O↑+3CO2↑,以此来解答。
(1)“酸浸”后,钛主要以TiOCl42-形式存在,相应反应的离子方程式为FeTiO3+4H++4Cl-= Fe2++TiOCl42-+2H2O;
(2)根据图示可知40℃时TiO2xH2O转化率最高,在低于40℃,TiO2xH2O转化反应速率随温度升高而增加,当温度超过40℃时,双氧水分解与氨气逸出导致TiO2xH2O转化反应速率下降;
(3)加入盐酸酸浸;FeTiO3反应产生Fe2+、TiOCl42-,MgO反应产生Mg2+,SiO2等杂质不溶于盐酸,过滤后的滤渣为SiO2,滤液①中含Mg2+、Fe2+、TiOCl42-,经水解后过滤,TiOCl42-形成沉淀为TiO2·xH2O,Mg2+、Fe2+仍然存在于滤液②中,所以“滤液②”中含有的金属离子是Mg2+、Fe2+;加入双氧水可将Fe2+氧化为Fe3+,Fe3+和磷酸反应形成FePO4沉淀,使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5 mol·L-1,由于FePO4的Ksp=1.3×10-22,所以此时溶液中c(PO43-)=![]() mol/L=1.3×10-17mol/L;
mol/L=1.3×10-17mol/L;
(4)“高温煅烧②”中由FePO4制备LiFePO4的化学方程式为2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑;
2LiFePO4+H2O↑+3CO2↑;
(5) Li2Ti5O15中Ti的化合价为+4,Li的化合价为+1价,由化合价的代数和为0可知,O元素的负价代数和为22,设过氧键的数目为x,则(x×2)×1+(15-x×2)×2=22,解得x=4,即过氧键数目为4;
(6)根据刀片电池正极材料的磷酸铁锂在充、放电时的局部放大示意图可知:正极得到电子,发生还原反应,则正极的电极反应式是:Li(1﹣x)FePO4+xLi++xe-=LiFePO4。

【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量__;充入氦气,混合气体的密度__(填“增大”“减小”或“不变”)。
(2)830℃,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
①写出CH3COOH的电离方程式____,其电离平衡常数表达式K a=___;
②根据表中数据判断,浓度均为0.01mol·L-1的下列三种物质的溶液中,酸性最强的是___(填编号);将下列各溶液分别稀释100倍,pH变化最小的是___(填编号)。
A.CH3COOH B.H2CO3 C.H2SO3