题目内容
 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同;C原子p轨道上成对电子数等于未成对电子数;D是电负性最大的元素;E原子是元素周期表上第一个4S能级有两个电子的原子;F的核外电子数等于A、B、C、D的电子数之和.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同;C原子p轨道上成对电子数等于未成对电子数;D是电负性最大的元素;E原子是元素周期表上第一个4S能级有两个电子的原子;F的核外电子数等于A、B、C、D的电子数之和.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)(1)比较B、C的第一电离能:B
(2)将D的单质通入氢氧化钠溶液中,可得到CD2.CD2是一种无色、几乎无味的剧毒气体,可用于火箭工程助燃剂等.请回答下列问题:
①CD2中O原子的杂化轨道类型是
②与H2O分子相比,CD2分子的极性更
(3)F元素原子的核外电子排布式是
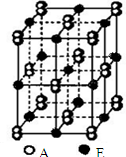
(4)A和E形成的晶体结构如右图所示,其晶体的化学式是
分析:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同,则A原子核外电子排布为1s22s22p2,则A为C元素;D是电负性最大的元素,则D为F元素;C原子p轨道上成对电子数等于未成对电子数,原子序数小于氟元素,故其外围分子排布为2s22p4,则C为O元素;B原子序数介于碳元素、氧元素之间,则B为N元素;E原子是元素周期表上第一个4s能级有两个电子的原子,则E为Ca元素;F的核外电子数等于A、B、C、D的电子数之和,则其核外电子数=6+7+8+9=30,则F为Zn元素,据此解答.
解答:解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同,则A原子核外电子排布为1s22s22p2,则A为C元素;D是电负性最大的元素,则D为F元素;C原子p轨道上成对电子数等于未成对电子数,原子序数小于氟元素,故其外围分子排布为2s22p4,则C为O元素;B原子序数介于碳元素、氧元素之间,则B为N元素;E原子是元素周期表上第一个4s能级有两个电子的原子,则E为Ca元素;F的核外电子数等于A、B、C、D的电子数之和,则其核外电子数=6+7+8+9=30,则F为Zn元素,
(1)N元素原子2p能级容纳3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能N>O;某元素形成的离子与单质O3互为等电子体,其化学式为NO2-,
故答案为:>;NO2-;
(2)①OF2中O原子价层电子对数=2+
=4,氧原子含有2对孤对电子,故O原子采取sp3杂化,FO2分子为V型结构,
故答案为:sp3;V型;
②氧和氟的电负性差小于氧和氢的电负性差,故与H2O分子相比,OF2分子的极性更小,
故答案为:小;氧和氟的电负性差小于氧和氢的电负性差;
(3)F为Zn元素,原子核外有30个电子,故其核外电子排布式是1s22s22p63s23p63d104s2;F的高价离子为Zn2+,能与B的简单氢化物NH3形成配位数为4的配离子的化学式为[Zn(NH3)4]2+,
故答案为:1s22s22p63s23p63d104s2;[Zn(NH3)4]2+;
(4)C和Ca形成的晶体,根据其晶体结构可知,晶胞中Ca原子数目=1+12×
=4,C原子数目=2×8×
+2×6×
=8,Ca原子与C原子数目之比为4:8=1:2,故其化学式是CaC2,属于离子化合物,碳原子之间形成共价键,含有离子键、共价键,
故答案为:CaC2;离子键、共价键.
(1)N元素原子2p能级容纳3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能N>O;某元素形成的离子与单质O3互为等电子体,其化学式为NO2-,
故答案为:>;NO2-;
(2)①OF2中O原子价层电子对数=2+
| 6-1×2 |
| 2 |
故答案为:sp3;V型;
②氧和氟的电负性差小于氧和氢的电负性差,故与H2O分子相比,OF2分子的极性更小,
故答案为:小;氧和氟的电负性差小于氧和氢的电负性差;
(3)F为Zn元素,原子核外有30个电子,故其核外电子排布式是1s22s22p63s23p63d104s2;F的高价离子为Zn2+,能与B的简单氢化物NH3形成配位数为4的配离子的化学式为[Zn(NH3)4]2+,
故答案为:1s22s22p63s23p63d104s2;[Zn(NH3)4]2+;
(4)C和Ca形成的晶体,根据其晶体结构可知,晶胞中Ca原子数目=1+12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:CaC2;离子键、共价键.
点评:本题综合考查物质结构与性质,涉及核外电子排布规律、杂化理论与分子结构、电离能、电负性、配合物、晶胞计算等,难度中等,注意掌握利用均摊法进行晶胞计算,侧重对知识的运用,需要学生全面注意基础知识.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.