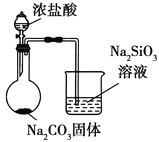
题目内容
【题目】X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是
(2)XY2﹣离子的立体构型是;R2+的水合离子中,提供孤电子对的原子是 .
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 . 
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是 .
【答案】
(1)1s22s22p4;Cl
(2)V形;O
(3)2:1
(4)2Cu+8NH3?H2O+O2=2[Cu(NH3)4]2++4OH﹣+6H2O
【解析】解:X、Y、Z、R为前四周期元素,且原子序数依次增大,XY2是红棕色气体,应是NO2 , 则X为N元素、Y为O元素;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等,则M层电子数为2,故Z为Mg;R2+离子的3d轨道中有9个电子,R原子核外电子数=2+8+8+9+2=29,则R为Cu元素,
(1.)Y为O元素,基态原子的电子排布式是1s22s22p4 , Z为Mg元素,所在周期中第一电离能最大的主族元素是Cl元素,所以答案是:1s22s22p4;Cl;
(2.)NO2﹣离子中心N原子孤电子对= ![]() =1,价层电子对数=2+1=3,故NO2﹣离子的立体构型是V形;Cu2+的水合离子中,提供孤电子对的原子是H2O中O原子,所以答案是:V形;O;
=1,价层电子对数=2+1=3,故NO2﹣离子的立体构型是V形;Cu2+的水合离子中,提供孤电子对的原子是H2O中O原子,所以答案是:V形;O;
(3.)晶胞中阳离子处于体心与顶点,晶胞中阳离子数目=1+8× ![]() =2,阴离子处于处于体内及面上,晶胞中阴离子数目=2+4×
=2,阴离子处于处于体内及面上,晶胞中阴离子数目=2+4× ![]() =4,故晶胞中阴离子与阳离子的个数比是4:2=2:1所以答案是:2:1;
=4,故晶胞中阴离子与阳离子的个数比是4:2=2:1所以答案是:2:1;
(4.)将Cu单质的粉末加入NH3的浓溶液中,通入O2 , 充分反应后溶液呈深蓝色,说明得到四氨合铜络离子,还应生成氢氧根离子与水,该反应的离子方程式是2Cu+8NH3H2O+O2=2[Cu(NH3)4]2++4OH﹣+6H2O,所以答案是:2Cu+8NH3H2O+O2=2[Cu(NH3)4]2++4OH﹣+6H2O.

 目标测试系列答案
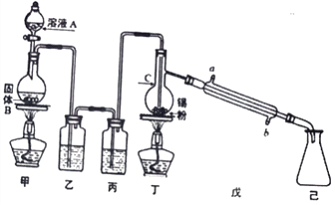
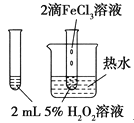
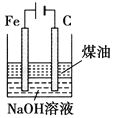
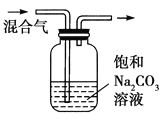
目标测试系列答案【题目】下列图中的实验方案,能达到实验目的的是( )
实验方案 | 实验目的 | |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
| 制备Fe(OH)2并能较长时间观察其颜色 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
【题目】钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
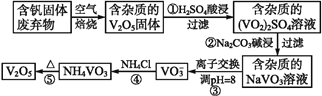
部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有______。
(2)反应②碱浸后滤出的固体主要成分是______(写化学式)。
(3)反应④的离子方程式为__________。
(4)25 ℃、101 kPa时,4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)
2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)![]() 2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
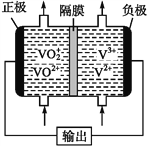
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为_______,电池充电时阳极的电极反应式是________。
【题目】合成氨是基本无机化工,氨是化肥工业和有机化工的主要原料,也是一种常用的制冷剂.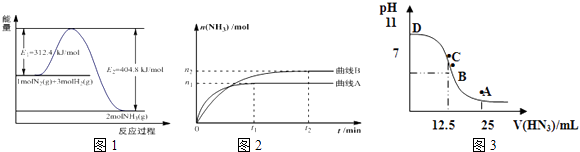
(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.①下列说法正确的是 .
A.使用催化剂会使E1的数值增大
B.△H=﹣92.4kJmol﹣1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 ![]() molL﹣1min﹣1
molL﹣1min﹣1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3molL﹣1、2molL﹣1、1molL﹣1时,此时刻该反应的v逆(N2)v正(N2) (填“>”、“<”或“=”).
(3)常温下向25mL0.1mol/LNH3H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.A、B、C、D四个点中,水的电离程度最大的是;A点时溶液中各离子浓度由小到大的顺序为 .
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl﹣NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式 .