题目内容
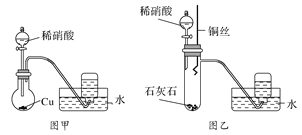
【题目】锡为第IVA族具有可变价的金属元素,其单质沸点为2260℃。四氯化锡(SnCl4)是无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室中可用氯气与过量金属锡通过下图装置制备SnCl4 (夹持装置已略去)。
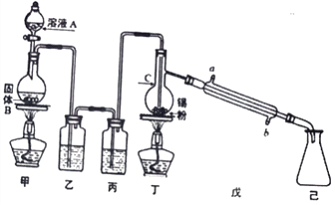
(1)仪器C的名称为___________,装置乙中的试剂是_____________。
(2)装置甲中发生反应的化学方程式为___________________________________。
(3)氯气与锡的反应类似与铁的反应,但该实验中对装置丁要持续加热,其原因是_____________。
(4)你认为该实验装置需要进行的改进是:__________________________________________。
(5)用下列方法和步骤测定所用金属锡样品的纯度(杂质不参加反应)
①将2.000g锡完全溶于过量稀盐酸中,并用所得溶液去还原过量的FeCl3稀溶液,最后得100.00mL 溶液。写出第二步反应的离子方程式:_____________________________。
②取①所得溶液amL用0.100 mol·L-1 的K2Cr2O7溶液滴定,发生如下反应:6FeCl2+ K2Cr2O7+ 14HCl=6FeCl3+2KCl+2CrCl3+7H2O。
K2Cr2O7溶液应注入到____式(填"酸或碱”) 滴定管中。到达滴定终点时用去bmL。则样品中锡的质量分数为_______%(用含a、b 的最简代数式表示)。
【答案】 蒸馏烧瓶 饱和食盐水 MnO2 + 4HCl (浓) ![]() MnCl2 + Cl2↑+ 2H2O 要将SnCl4蒸馏出 在己装置后加装盛有碱石灰的干燥管 Sn2++2Fe3+=Sn4++2Fe2+ 酸
MnCl2 + Cl2↑+ 2H2O 要将SnCl4蒸馏出 在己装置后加装盛有碱石灰的干燥管 Sn2++2Fe3+=Sn4++2Fe2+ 酸 ![]() %
%
【解析】工业上常用氯气与金属锡反应制备四氯化锡,丁装置烧瓶中含有Sn,则甲装置的目的是制取氯气,常用MnO2和浓盐酸在加热条件下制取,发生的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,加热促进挥发,水在加热条件下易变成水蒸气,所以生成的氯气中含有HCl、H2O;SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发,为防止丁中生成的SnCl4水解和Sn与HCl反应,则乙、丙装置要除去HCl、H2O,用饱和的食盐水除去HCl,用浓硫酸干燥Cl2;己中收集的物质是SnCl4。
MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,加热促进挥发,水在加热条件下易变成水蒸气,所以生成的氯气中含有HCl、H2O;SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发,为防止丁中生成的SnCl4水解和Sn与HCl反应,则乙、丙装置要除去HCl、H2O,用饱和的食盐水除去HCl,用浓硫酸干燥Cl2;己中收集的物质是SnCl4。
(1)根据装置图,仪器C为蒸馏烧瓶,根据上述分析,装置乙中的试剂是饱和食盐水,目的是除去氯气中的氯化氢,故答案为:蒸馏烧瓶;饱和食盐水;
(2)装置甲中固体B为黑色粉末,为二氧化锰,二氧化锰和浓盐酸在加热条件下发生氧化还原反应生成氯化锰、氯气和水,反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)氯气与锡的反应类似与铁的反应,生成的SnCl4需要及时蒸馏出去,便于提高原料的利用率,因此实验中对装置丁要持续加热,故答案为:要将SnCl4蒸馏出;
(4)SnCl4发生水解,为防止水解,要防止外界的水蒸气进入己装置,所以改进措施为在己装置后加装盛有碱石灰的干燥管,同时可以吸收未反应的氯气,防止污染环境,故答案为:在己装置后加装盛有碱石灰的干燥管;
(5)①将2.000g锡完全溶于过量稀盐酸中,锡与盐酸发生反应:Sn+2HCl═SnCl2+H2↑,用所得溶液去还原过量的FeCl3稀溶液,发生的反应为:SnCl2+2FeCl3═SnCl4+2FeCl2,反应的离子方程式为Sn2++2Fe3+=Sn4++2Fe2+,故答案为:Sn2++2Fe3+=Sn4++2Fe2+;
②K2Cr2O7溶液具有强氧化性,可氧化腐蚀橡胶,则K2Cr2O7溶液应装在酸式滴定管中,滴定时发生反应:6 Fe2++Cr2O72-+14 H+═6 Fe3++2 Cr3++7 H2O,根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,反应中消耗的K2Cr2O7的物质的量为0.100mol/L×b×10-3L,故n(Sn)=3n(K2Cr2O7)×![]() =3×0.100mol/L×
=3×0.100mol/L×![]() ×10-3L=
×10-3L=![]() mol,Sn的质量为:
mol,Sn的质量为: ![]() mol×118.7g/mol=
mol×118.7g/mol=![]() g,样品中锡的质量分数为:
g,样品中锡的质量分数为: ![]() ×100%=
×100%=![]() %,故答案为:酸;
%,故答案为:酸;![]() %。
%。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】已知25℃时,几种酸的电离平衡常数如下表所示。
序号 | ① | ② | ③ | ④ |
酸 | HF | CH3COOH | H2SeO4 | H2CO3 |
Ka1 | 6.4×10-4 | 1.8×10-5 | 完全电离 | 4.4×10-7 |
Ka2 | 1.0×10-2 | 4.7×10-11 |
(1)25℃时,pH=3 的盐酸V1mL与pH= 12 的氢氧化钠溶液V2mL混合后恰好成中性,则V1:V2=____:___。
(2)25℃时,0.1mol·L-1 HF 溶液的 c(H+)约为______mol·L-1 。将pH均3 的①、②、③溶液分别加水稀释至原来的10 倍,溶液的pH 大小关系:_____ (填序号)。
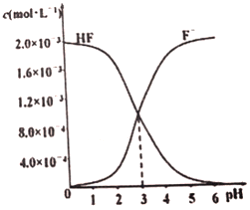
(3)在T℃时调节2.0×10-3mol·L-1 的氢氟酸水溶液的pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH 的关系如图所示。则HF 电离平衡常数为Ka(HF)=_________。
(4)向H2SeO4 溶液中滴加少量氨水,反应的离子方程式为___________________________。若将一定浓度的KHCO3 和KHSeO4两溶液混合,反应的离子方程式为_________________________。