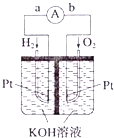
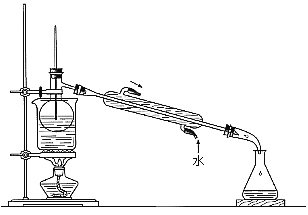
题目内容
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
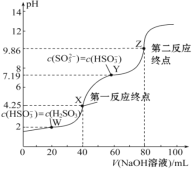
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
【答案】C
【解析】
用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO4溶液,由于H2SO3是二元酸,滴定过程中存在两个化学计量点,滴定反应为:NaOH+H2SO3═NaHSO3+H2O,NaHSO3+NaOH═Na2SO3+H2O,完全滴定需要消耗NaOH溶液的体积为80mL,结合溶液中的守恒思想分析判断。
A.由图像可知,当溶液中c(HSO3-)= c(SO32-)时,此时pH=7.19,即c(H+)=10-7.19mol/L,则H2SO3的Ka2=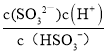 =c(H+),所以H2SO3的Ka2=1×10-7.19,Ka2(H2SO3)的数量级为10-8,故A正确;
=c(H+),所以H2SO3的Ka2=1×10-7.19,Ka2(H2SO3)的数量级为10-8,故A正确;
B.第一反应终点时,溶液中恰好存在NaHSO3,根据图像,此时溶液pH=4.25,甲基橙的变色范围为3.1~4.4,可用甲基橙作指示剂,故B正确;
C.Z点为第二反应终点,此时溶液中恰好存在Na2SO3,溶液pH=9.86,溶液显碱性,表明SO32-会水解,考虑水也存在电离平衡,因此溶液中c(OH-)>c(HSO3-),故C错误;
D.根据图像,Y点溶液中c(HSO3-)=c(SO32-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),由于c(HSO3-)=c(SO32-),所以3c(SO32-)=c(Na+)+c(H+)-c(OH-),故D正确;
答案选C。

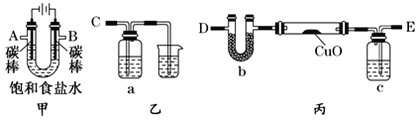
【题目】根据下列实验现象,所得结论错误的是
实验 | 实验现象 | 结论 |
A |
| 活动性:Al>Fe>Cu |
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.AB.BC.C
D.D