题目内容
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态铜原子的价电子排布式为___。
(2)Na、O、S简单离子半径由大到小的顺序为___。
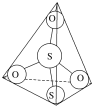
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为___。
(4)Na3[Ag(S2O3)2]中存在的作用力有__。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子中硫原子的价层电子对数为__,其分子空间构型为___。SO2易溶于水,原因是__。
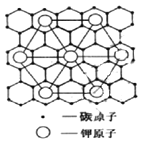
(6)SO2具有较强的还原性,碳与熔融金属钾作用,形成的晶体是已知最强的还原剂之一,碳的某种晶体为层状结构,钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图所示,则其化学式可表示为___。
(7)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图像的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,试通过这些数据列出计算阿伏加德罗常数的算式___。
【答案】3d104s1 S2-、O2-、Na+ sp3 ABE 3 V形 根据相似相溶原理,SO2和水均为极性分子,且SO2和水反应 KC8(或C8K) NA=![]() mol-1
mol-1
【解析】
(1)铜为29号元素,基态铜原子的价电子排布式为3d104s1。答案为:3d104s1;
(2)Na、O、S简单离子中,S2-的电子层数为三层,Na+、O2-的电子层数为二层,且O的核电荷数小,离子半径大,所以离子半径由大到小的顺序为S2-、O2-、Na+。
答案为:S2-、O2-、Na+;
(3)S2O32-离子,其中心硫原子的杂化轨道类型为sp3。答案为:sp3;
(4)Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、配位键。
答案为:ABE;
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子中硫原子的价层电子对数为3。
答案为:3;
其分子空间构型为V形。答案为:V形;
SO2易溶于水,原因是根据相似相溶原理,SO2和水均为极性分子,且SO2和水反应。
答案为:根据相似相溶原理,SO2和水均为极性分子,且SO2和水反应;
(6)从常见结构的平面投影分析,在一个三角形内,K原子占3×![]() =
=![]() 个,而C原子占4个,所以其化学式可表示为KC8(或C8K)。答案为:KC8(或C8K);
个,而C原子占4个,所以其化学式可表示为KC8(或C8K)。答案为:KC8(或C8K);
(7)金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,设晶胞的边长为x,则x2+x2=(4a)2,x=2![]() m,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,一个晶胞含有4个金原子,则通过这些数据列出计算阿伏加德罗常数的算式得:NA=
m,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,一个晶胞含有4个金原子,则通过这些数据列出计算阿伏加德罗常数的算式得:NA=![]() mol-1,
mol-1,
答案为:![]() mol-1。
mol-1。

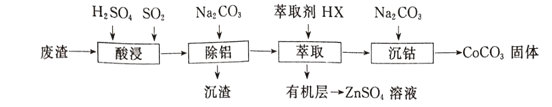
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式____________________。
(2)“除铝”过程中需要调节溶液pH的范围为_______________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
(4)简述洗涤沉淀的操作____________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为 ____________________。