题目内容
【题目】铜及其化合物在工业生产和日常生活中有着广泛的应用。
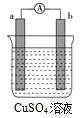
某化学小组拟采用如下装置(夹持和加热仪器已略去)来测定铜的相对原子质量,同时检验氯气的氧化性。
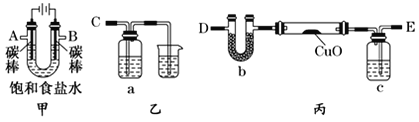
(1)装置甲中发生反应的化学方程式是:__________。
(2)已知装置甲中B处有黄绿色的气体产生,且 B连C ;则A连________(填写连接的字母)。
(3)乙装置的a瓶中溶液可以是________(填标号)
A 酸性KMnO4溶液 B CCl4溶液 C 滴加有KSCN溶液的FeCl2溶液 D 饱和食盐水
(4)在检查装置气密性后,加热丙装置硬质玻璃管里的CuO粉末前,还需要进行的操作为________。
(5)准确称量m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为____________(只要求列出算式)。该实验方案的装置有不合理之处,若不加以改进会导致测定结果__________ (填“偏大”、“偏小”或“不变”)。
(6)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧CuCl2样品时,铜的焰色为__________(填标号)。
A 绿色 B 红色 C 紫色 D 黄色
(7)向CuCl2溶液中通人H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2+ + H2S=CuS(s) + 2H+,则该反应的平衡常数K=_________(保留一位小数)。已知:CuS溶度积Ksp=1.0×10-36,H2S电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。
【答案】2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH E C 利用H2排尽装置中的空气 (检验H2的纯度)
H2↑+Cl2↑+2NaOH E C 利用H2排尽装置中的空气 (检验H2的纯度) ![]() 偏小 A 9.1×1014
偏小 A 9.1×1014
【解析】
甲为电解装置,A为阴极,生成氢气,经干燥后与氧化铜在加热条件下反应,Y为浓硫酸,起到干燥氢气的作用,氢气从E进入,D可防止空气中的水进入,B为电解池的阳极,生成氯气,验证氯气的氧化性,可将B连接C,X应为KI淀粉溶液,如溶液变为蓝色,可说明氯气具有强氧化性,生成碘,以此解答该题。
(1)电解饱和食盐水,生成氢气、氯气和氢氧化钠,反应的方程式为2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH;
故答案为:2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH;
(2)A是阴极,阴极上产生的是氢气,B是阳极,阳极上产生的是氯气,要用氢气来还还原氧化铜,所以A连接E;
故答案为:E;
(3)氯气具有氧化性,能与FeCl2溶液,把亚铁离子氧化成铁离子,遇到硫氰化钾溶液变红色,滴加有KSCN溶液的FeCl2溶液;
故答案为:C;
(4)氢气还有氧化铜,需要排装置里的空气,在检查装置气密性后,加热丙装置硬质玻璃管里的CuO粉末前,还需要进行的操作为排空气;
故答案为:利用H2排尽装置中的空气 (检验H2的纯度);
(5)设Cu的相对原子质量为x,由反应前后氧元素的质量是不变的,得等式为:m×![]() = b×
= b×![]() ,解得:x=
,解得:x=![]() ;若不加以改进会使b的增重量增加,测得铜的相对原子质量偏小;
;若不加以改进会使b的增重量增加,测得铜的相对原子质量偏小;
故答案为: ![]() ; 偏小;
; 偏小;
(6)灼烧CuCl2样品时,含有铜元素,焰色反应是绿色;
故答案为:A;
(7) 反应的平衡常数K=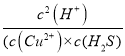 =
= =
=![]() =
=![]() =9.1×1014;
=9.1×1014;
故答案是:9.1×1014。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案【题目】某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量MnSO4固体 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量Na2SO4固体 |
褪色时间/s | 116 | 6 | 117 |
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
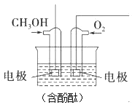
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。
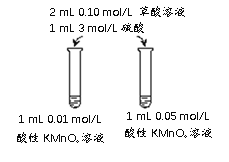
a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
【题目】有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大
②E元素的电离能数据见下表(kJ·mol-1):
I1 | I2 | I3 | I4 | … |
496 | 4562 | 6912 | 9540 | … |
③B与F分别同主族
④A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物
⑤B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、______________
(2)B2A2分子中存在____个σ键,____个π键
(3)E2D2电子式____________
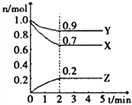
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
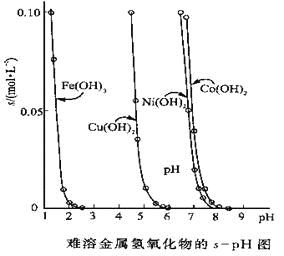
(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___ (能、不能)通过调节溶液pH的方法来除去,理由是_________。
(4)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______除去它们。
A.NaOH B.FeS C.Na2S