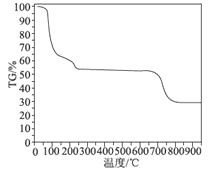
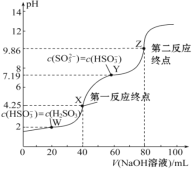
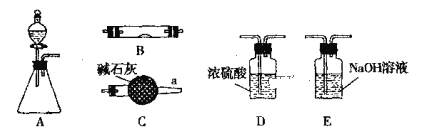
题目内容
【题目】根据下列实验现象,所得结论错误的是
实验 | 实验现象 | 结论 |
A |
| 活动性:Al>Fe>Cu |
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.AB.BC.C
D.D
【答案】B
【解析】
A.Ⅰ烧杯中铁表面有气泡,说明铁作正极、而铝作负极,说明活动性:Al>Fe;Ⅱ烧杯中铜表面有气泡,说明铜作正极、而铁作负极,活动性Fe>Cu,综上所述,活动性:Al>Fe>Cu,A所得结论正确;
B. 试管中收集到无色气体不能说明铜与浓硝酸的反应产物是NO,因为即使生成二氧化氮,在用排水法收集该气体时,也会与水反应生成NO,故B所得结论是错误的;
C. 向氯化铁溶液中加入浓度较小的硫氰化钾溶液,溶液变红,再向该试管中加和饱和的硫氰化钾溶液,试管b比试管a中溶液的红色深,由于该反应是可逆反应,故增大反应物浓度,平衡向正反应方向移动,C所得结论正确;
D. 关闭止水夹,向长颈漏斗内加水,发现长颈漏斗内液面高于烧瓶内液面且保持不变,说明该装置气密性良好,D所得结论正确。
故选B。

【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
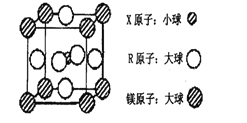
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
【题目】有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大
②E元素的电离能数据见下表(kJ·mol-1):
I1 | I2 | I3 | I4 | … |
496 | 4562 | 6912 | 9540 | … |
③B与F分别同主族
④A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物
⑤B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、______________
(2)B2A2分子中存在____个σ键,____个π键
(3)E2D2电子式____________