题目内容
12.下列反应的离子方程式正确的是( )| A. | 氯气跟烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| B. | 漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 将氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
分析 A.氯气为氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
B.次氯酸具有强氧化性,能够将亚硫酸钙氧化成硫酸钙;
C.磷酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者恰好反应生成偏铝酸根离子;
D.离子方程式两边总电荷不相等,违反了电荷守恒.
解答 解:A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═ClO-+Cl-+H2O,故A错误;
B.漂白粉溶液中通入足量的SO2气体,二者发生氧化还原反应,正确的离子方程式为:Ca2++2ClO-+2H2O+2SO2═CaSO4↓+SO42-+4H++2Cl-,故B错误;
C.明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀,铝离子完全转化成偏铝酸根离子,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故C正确;
D.将氯气通入氯化亚铁溶液中,二者发生反应生成氯化铁,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故D错误;
故选C.
点评 本题考查离子反应方程式书写,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
3.下列说法正确的是( )
| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中一定没有共价键 | |
| D. | 离子化合物一定含有金属元素 |
7.M、N、X、Y四种物质之间有如下转化关系(反应条件和其它产物已略去).下列选项不符合的是( )


| A. | M:MaOH X:CO2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:Al X:NaOH |
17.下列说法中正确的是( )
| A. | 分液时,水溶液一定从下口放出 | |
| B. | 蒸馏时,如果温度计水银球下端高于蒸馏烧瓶支管口上沿,收集到的馏分沸点偏高 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 量取20.0mL浓硫酸时,俯视读数,所取液体体积偏大 |
4.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况屯的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 在上述五种元素形成的单质中,X元素可形成几种同素异形体 | |
| C. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定没有离子键 |
1.短周期元素R、T、X、Y、Z在元素周期表的相对位置如表所示,它们的最外层电子数之和为31.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第ⅣA族 | |
| B. | 原子半径:X<R<T | |
| C. | 最简单气态氢化物稳定性:T>R>Y | |
| D. | 最高价氧化物的水化物酸性:T>R>Y |
16.下列化学用语表述正确的是( )
| A. | 一氯甲烷的结构式CH3Cl | B. | 苯的分子式C6H6 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 氮气的电子式 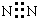 |

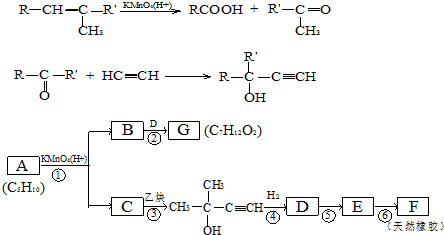
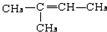 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2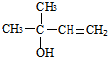 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$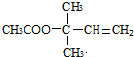 +H2O;
+H2O; .
.