题目内容
18. 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)
将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)(1)生成沉淀的质量刚好最大时,反应的离子方程式为:CO2+Ca(OH)2=CaCO3↓+H2O.
(2)原混合物中Ca(OH)2的质量为0.74g.
(3)沉淀恰好溶解时,消耗CO2的体积为896mL.
(4)在如图坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线.
分析 KOH和Ca(OH)2混合物溶于水中形成稀溶液,通入足量的CO2气体所发生的离子反应有:
①2OH-+CO2=CO32-,②CO32-+Ca2+=CaCO3↓③CaCO3+CO2+H2O=Ca(HCO3)2,
根据以上反应,可把反应分为四个阶段:
(1)二氧化碳会先和氢氧化钙反应生成碳酸钙沉淀,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
(2)二氧化碳会继续和氢氧化钾反应,方程式为2K0H+CO2=K2CO3+H2O,
(3)二氧化碳会继续和碳酸钾反应,方程式为K2CO3+CO2+H2O=2KHCO3,
(4)二氧化碳会继续和碳酸钙反应生成碳酸氢钙,方程式为CaCO3+CO2+H2O=Ca(HCO3)2,
据消耗CO2的体积为224mL结合化学方程式计算.
解答 解:(1)二氧化碳会先和氢氧化钙反应生成碳酸钙沉淀,当将氢氧化钙恰好完全反应时即得沉淀的最大量,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)根据反应方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
设氢氧化钙的物质的量为x,那么x应该等于二氧化碳的量,即$\frac{0.224L}{22.4L/mol}$=0.01mol,
所以氢氧化钙的质量为0.01mol×74g/mol=0.74g,
故答案为:0.74;
(3)1.86gKOH和Ca(OH)2混合物中,n(KOH)=$\frac{1.86g-0.74g}{56g/mol}$=0.02mol,
沉淀恰好溶解时,所反应的反应以此有:
①CO2 +Ca(OH)2 =CaCO3↓+H2O
0.01mol 0.01mol
②2K0H+CO2 =K2CO3+H2O
0.02mol 0.01mol
③K2CO3 +CO2 +H2O=2KHCO3,
0.01mol 0.01mol
④CaCO3 +CO2 +H2O=Ca(HCO3)2
0.01mol 0.01mol
沉淀恰好溶解时,消耗CO2的物质的量为0.01mol+0.01mol+0.01mol+0.01mol=0.04mol,
体积为:0.04mol×22.4L/mol=0.896L,即896ml,
故答案为:896;
(4)根据(4)分析可画出图象为: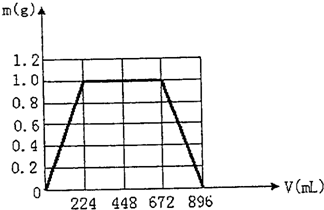 ,故答案为:
,故答案为: .
.
点评 本题考查混合物的计算,题目难度较大,注各阶段的反应物的物质的量以及发生的化学反应,根据化学方程式来计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 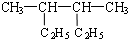 的名称是2,3-二甲基己烷 的名称是2,3-二甲基己烷 | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 有机物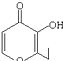 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 | |
| D. | 反应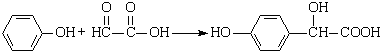 属于加成反应,理论上该反应的原子利用率为100% 属于加成反应,理论上该反应的原子利用率为100% |
| A. | 自来水厂常用氯气给自来水消毒 | |
| B. | 澄清石灰可用于水鉴别Na2CO3和NaHCO3溶液 | |
| C. | 合金的机械性能一般比组分金属好,但有可能更加容易被腐蚀 | |
| D. | 加碘盐是在食盐中加入一定量的碘酸钾,以确保人体对碘的摄入量,可预防甲状腺肿大 |
| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中一定没有共价键 | |
| D. | 离子化合物一定含有金属元素 |
(2)为证明盐的水解是吸热反应,四位学生分别设计了如下实验方案,其中正确的是甲乙
甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明盐类水解是吸热反应
丙.将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
(3)用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作造成测定结果偏高的是BC
A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失
C.滴定终点读数时,仰视定管刻度,其他操作正确
(4)用物质的量浓度为0.1000mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,分别取20.00mL 草酸溶液于3个洁净的锥形瓶,用标准的KMnO4(H+)溶液滴定至终点,数据如表:
| 测定次数 | 第一次 | 第二次 | 第三次 |
| 初始读数(mL) | 0.40 | 0.90 | 0.00 |
| 终点读数(mL) | 25.05 | 21.00 | 19.90 |
请回答下列问题:
①标准KMnO4溶液应装在酸式(选填“酸式”或“碱式”)滴定管中;
②判断已达滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③实验测得草酸溶液的物质的量浓度为0.2500mol/L.(保留四位有效数字)
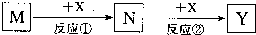
| A. | M:MaOH X:CO2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:Al X:NaOH |
⑦红褐色的氢氧化铁液体; ⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 酸性氧化物 | 碱性氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是2:3,当有3.2g Cu发生反应时,转移电子的物质的量为0.1mol.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
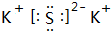 .
.