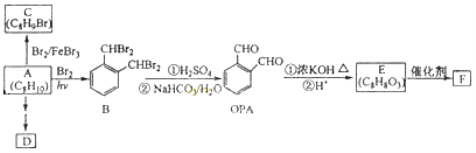
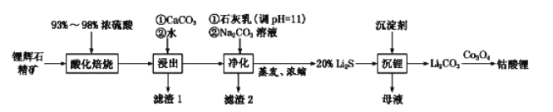
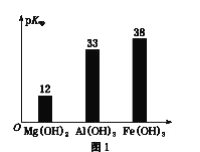
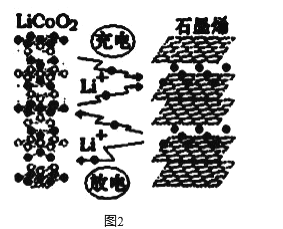
题目内容
【题目】已知:H2(g)+F2(g)=2HF(g);ΔH= -270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJ
C.在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量
D.该反应中的能量变化可用如图来表示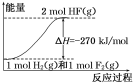
【答案】C
【解析】
A.生成HF的反应△H<0,说明该反应为放热反应,因此逆反应为吸热反应,故A错误;
B.气态HF转化成液态HF放出热量,因此1mol H2(g)与1mol F2(g)反应生成2mol液态HF放出的热量大于270kJ,故B错误;
C.生成HF气体的反应是放热反应,反应物总能量大于生成物总能量,故C正确;
D.放热反应中反应物总能量大于生成物总能量,即1mol H2(g)和1mol F2(g)具有的总能量比2mol HF(g)的能量高,故D错误;
答案:C。

练习册系列答案
相关题目