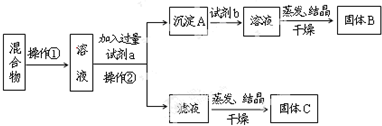
题目内容
15.甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-或I-),向甲溶液中加入淀粉溶液和氯水,则溶液变为黄色,再加入丙溶液,颜色颜色变蓝,则甲、乙、丙依次含有的卤素离子有( )| A. | Br-、Cl-、I- | B. | Cl-、I-、Br- | C. | I-、Br-、Cl- | D. | Br-、I-、Cl- |
分析 卤族元素中,其单质的氧化性随着原子序数增大而减弱,其简单阴离子的还原性随着原子序数增大而增强,所以卤族元素中原子序数小的单质能置换出原子序数大的单质,以此解答该题.
解答 解:向甲中加入淀粉溶液和新制氯水,溶液变为橙色而不是蓝色,说明甲中含Br-,发生的反应为:2Br-+Cl2═Br2+2Cl-;再加入丙溶液,颜色颜色变蓝,生成碘单质,说明丙溶液中含有I-.乙溶液含Cl-,甲含Br-,
故选:A.
点评 本题以置换反应为载体考查同一主族性质递变规律,明确同一主族元素性质递变规律即可解答,知道非金属性强弱判断方法,熟练掌握元素周期律内涵并会灵活运用,题目难度不大.

练习册系列答案
相关题目
10.完全沉淀等体积、等物质的量浓度的AgNO3溶液,需要加入等浓度的NaCl、MgCl2、AlCl3溶液的体积之比为( )
| A. | 1:1:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
7.某同学需要用到120mL 1mol/L的盐酸溶液,现用密度为1.18g/mL,质量分数为36.5%浓盐酸配制,填空并请回答下列问题:
(1)配制0.1mol/L的盐酸溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAED;
A、用30mL水洗涤烧杯内壁和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,将量好的浓盐酸倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正.E,继续往容量瓶内小心加水到溶液离刻度线1~2 cm处,改用胶头滴管滴加水至凹液面恰好与刻度线相切.
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①所用的浓盐酸长时间放置在密封不好的容器中偏低;
②若加蒸馏水时不慎超过了刻度偏低;
③若定容时俯视刻度线偏高;
④用量筒量取浓盐酸时仰视偏高.
(1)配制0.1mol/L的盐酸溶液
| 量筒量取浓盐酸体积/mL | 应选用量筒的规格(可供选择的规格10mL、25mL、50mL) | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
| ①2.1mL | ②25 mL | ③250 mL | ④烧杯、玻璃棒、胶头滴管、量筒 |
A、用30mL水洗涤烧杯内壁和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,将量好的浓盐酸倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正.E,继续往容量瓶内小心加水到溶液离刻度线1~2 cm处,改用胶头滴管滴加水至凹液面恰好与刻度线相切.
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①所用的浓盐酸长时间放置在密封不好的容器中偏低;
②若加蒸馏水时不慎超过了刻度偏低;
③若定容时俯视刻度线偏高;
④用量筒量取浓盐酸时仰视偏高.
12.如图图是实验室制取乙烯的发生、净化和用排水法测量生成C2H4体积的实验装置图:图中A、B、C、D、E、F的虚线部分是玻璃导管接口,接口的弯曲和伸长部分未画出.根据要求填写下列各小题空白.

(1)若所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号):③接①接②接④.其中①与②装置相连时,玻璃导管连接(用装置中字母表示)应是B接D.
(2)若加热时间过长,温度过高生成的乙烯中常混有SO2,为除去SO2,装置①中应盛的试剂是氢氧化钠溶液.
(3)装置③中碎瓷片的作用是防止暴沸,浓H2SO4的作用是脱水剂和催化剂,此装置中发生的主要反应的化学方程式是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(4)实验开始时首先应检查装置的气密性,实验结束时,应先拆去A处(用装置中字母表示)的玻璃导管,再熄灭③处的酒精灯.
(5)实验结束时若装置④中水的体积在标况下为0.112L,则实验中至少消耗乙醇0.005mol.
| 装置序号 | ① | ② | ③ | ④ |
| 各仪器装置图 | 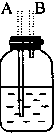 | 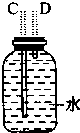 | 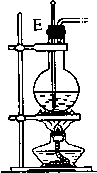 |  |

(1)若所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号):③接①接②接④.其中①与②装置相连时,玻璃导管连接(用装置中字母表示)应是B接D.
(2)若加热时间过长,温度过高生成的乙烯中常混有SO2,为除去SO2,装置①中应盛的试剂是氢氧化钠溶液.
(3)装置③中碎瓷片的作用是防止暴沸,浓H2SO4的作用是脱水剂和催化剂,此装置中发生的主要反应的化学方程式是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(4)实验开始时首先应检查装置的气密性,实验结束时,应先拆去A处(用装置中字母表示)的玻璃导管,再熄灭③处的酒精灯.
(5)实验结束时若装置④中水的体积在标况下为0.112L,则实验中至少消耗乙醇0.005mol.

 (Ⅰ)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(Ⅰ)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答: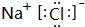 .
.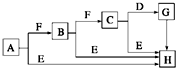 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.